摘要: 贝伐珠单抗(Avastin®)是罗氏公司于2004年获批上市的抗肿瘤血管生成药物,它通过特异性靶向血管内皮生长因子(VEGF)阻断与内皮细胞表面受体(Flt-1和KDR)的结合发挥抗肿瘤作用。但该药物对国内肿瘤患者造成极大的经济负担,因此,研发其生物类似药意义重大。Biacore T200利用表面等离子共振技术可实时、无标记地检测生物分子间的相互作用,表征分子间相互作用的动力学、亲和力等。因此,本试验方案利用该设备检测重组人源化抗VEGF单抗和阳性抗体Avastin与Fc受体FcγRI(CD64)、FcγRII(CD32a,167His)、FcγRII(CD32a,167Arg)、FcγRII(CD32b)、FcγRIII(CD16a,176Phe)、FcγRIII(CD16a,176Val)、FcγRIII(CD16b)、FcRn的结合、解离情况以及亲和力值,以评价生物类似药与原研抗体药物在抗体依赖性细胞介导的细胞毒性作用即ADCC(antibody-dependent cell-mediated cytotoxicity)效应、抗体依赖性细胞介导的吞噬作用即ADCP(antibody dependent cellular phagocytosis)效应以及抗体药物的半衰期方面是否具有生物等效性。实验结果显示:在本实验条件下,供试抗体重组人源化抗VEGF单抗和阳性抗体Avastin与Fc受体及FcRn(缓冲液pH 6.0和pH 7.4)的结合、解离常数以及亲和力值一致,说明重组人源化抗VEGF单抗生物类似药与阳性抗体贝伐珠单抗Avastin在发挥Fc效应方面具有生物等效性。
关键词: 表面等离子共振技术, 重组人源化抗VEGF单抗, Fc受体, 亲和力分析
材料与试剂
- 供试抗体重组人源化抗VEGF单抗 (东曜药业有限公司, 产品目录号: ADS20170601)
- 阳性抗体Avastin® (罗氏公司, 产品目录号: H0198B05)
- FcγRI (CD64) (ACRO Biosystems, 产品目录号: FCA-H52H2)
- FcγRIIa (CD32a, 167His) (Sino Biological, 产品目录号: 10374-H08H1)
- FcγRIIa (CD32a, 167Arg) (Sino Biological, 产品目录号: 10374-H08H)
- FcγRIIb (CD32b) (Sino Biological, 产品目录号: 10259-H08H)
- FcγRIIIa, (CD16a, 176Val) (Sino Biological, 产品目录号: 10389-H08H1)
- FcγRIIIa (CD16a, 176Phe) (Sino Biological, 产品目录号: 10389-H08H)
- FcγRIIIb (CD16b) (Sino Biological, 产品目录号: 11046-H08H)
- FcRn (ACRO Biosystems, 产品目录号: FCM-H5286)
- Series S CM5芯片(Cytiva,产品目录号: BR-1005-30)
- 氨基偶联试剂盒(Cytiva,产品目录号: BR-1000-50)
- 10× HBS-EP+ 缓冲液(Cytiva,产品目录号: BR-1006-69)
- 抗His标签抗体偶联试剂盒(Cytiva,产品目录号: 28-9950-56)
- 醋酸钠缓冲液 (Cytiva, Acetate 4.5, 产品目录号: BR100350; Acetate 5.0, 产品目录号: BR100351; Acetate 5.5, 产品目录号: BR100352)
- 50 mM NaOH溶液 (Cytiva,产品目录号: BR100358)
- BIAtest Solution with HBS-N (Cytiva,产品目录号: 210310)
- 96孔板 (Greiner-650101, 产品目录号: E15073K6)
- 96孔板封膜 (Cytiva,产品目录号: 2045469/17)
- HBS-EP+ 缓冲液 (见溶液配方)
- 供试抗体和阳性抗体的配制 (见溶液配方)
仪器设备
- 生物分子相互作用仪 (Cytiva, Biacore T200)
- Milli-Q Advantage A10 超纯水系统(默克密理博,Merck Millipore)
实验步骤
一、系统检测(System Check)
进行正式实验前,对Biacore T200仪器(图1)进行系统检测(检测项目见图2),打开 Control Software,逐步点击Tools、More Tools、Test Tools、System Check,选Reagent、Refractometer Performance、Injections、Noise,然后点击Start,将695 μL BIAtest Solution 置于Rack 1架上,并放置4个1.5 mL空EP管,执行System Check,检测结果中Reagent pump、Mixing、Refractometer、Injections、Noise各项都显示“Pass”方可进行实验(系统检测报告结果见图3)。

图1 Biacore T200

图2 系统检测(System Check)

图3 系统检测(System Check)报告结果(部分)
二、Anti-his抗体的偶联
本实验分析8种Fc受体(带有His标签)与供试抗体重组人源化抗VEGF单抗以及阳性抗体Avastin的亲和力,因此,我们采用氨基偶联法将His Capture Kit中抗anti-his抗体偶联至CM5芯片的Fc1、Fc2通道,然后捕获Fc受体的方法进行下列实验。首先将100 μL EDC与100 μL NHS混匀,以10 μL/min流速活化芯片表面420 s,然后使用Wizard方法偶联经pH 4.5 的醋酸钠稀释的anti-his抗体,用1M乙醇胺封闭芯片表面420 s(偶联过程见图4)。偶联结束后使用上样缓冲液以10 μL/min的流速冲洗芯片表面,使基线保持稳定。
三、抗体与Fc受体的亲和力测定
为了保证抗体药物的临床疗效和安全性,除了检测亲和力和抗原特异性外,还需要对抗体的ADCC、ADCP效应以及药物的半衰期等进行评价。根据生物类似药研发与评价技术指导原则(试行),抗体与FcRn、Fcγ等各受体的亲和力是评价生物类似药与阳性抗体是否具有生物等效性的一项指标。ADCC主要由中性粒细胞和自然杀伤细胞的表面受体FcγRIIIa (CD16a)介导杀伤靶细胞。ADCP主要由巨噬细胞、中性粒细胞、吞噬性单核细胞表面的FcγR诱导抗体依赖性的吞噬作用,这些受体包括FcγRI (CD64)、FcγRIIa (CD32a)、FcγRIIb (CD32b)、FcγRIIIa (CD16a)、FcγRIIIb (CD16b)。另外,FcRn受体与抗体的Fc端以pH依赖的方式相互作用减缓IgG的降解,延长其血清半衰期。因此,本实验将进行供试抗体重组人源化抗VEGF单抗、阳性抗体Avastin分别与Fc受体的亲和力测定,有FcγRI(CD64)、FcγRII(CD32a,167His)、FcγRII(CD32a,167Arg)、FcγRII(CD32b)、FcγRIII(CD16a,176Phe)、FcγRIII(CD16a,176Val)、FcγRIII(CD16b)、FcRn。整个亲和力测定的步骤包括:捕获Fc受体、抗体与受体的结合、抗体与受体的解离以及芯片表面的再生。Fc受体捕获量RL以由公式计算所得值为参考,RL代表受体的捕获量,实际捕获量一般为1.5 RL。Rmax代表芯片的最大结合容量,需低于100 RU(Resonance Unit);Sm 为化学计量比,一般设为1;Ligand MW 为偶联在芯片上分子的分子量,Analyte MW 为分析物的分子量。本实验中,Fc受体的分子量为23–50 kDa,分析物抗体的分子量为150 kDa。经下列公式计算,Fc受体的捕获量为20–50 RU。

将FcγRI(CD64)用10 mM醋酸钠(pH4.5)稀释为0.5 μg/mL,以10 μL/min的流速捕获至Fc2通道上,捕获时间20s,Fc1作为参比通道;将抗体分别以0 nM、0 nM、1.25 nM、2.5 nM、5 nM、10 nM、20 nM、20 nM的浓度,以30 μL/min流经芯片的Fc1、Fc2通道,结合解离时间分别设为180 s和300 s,最后使用pH 1.5甘氨酸盐酸对芯片表面再生45s。抗体与受体FcγRII(CD32a,167His)亲和力测定时,抗体浓度分别稀释为0 μM,0 μM,0.3125 μM,0.625 μM,1.25 μM,2.5 μM,5 μM,10 μM,10 μM,结合解离分别为45 s,其他条件与上述一致;抗体与受体FcγRII(CD32a,167Arg)亲和力测定时,条件同FcγRII(CD32a,167His)一致;抗体与受体FcγRII(CD32b)亲和力测定时,将抗体分别以0 μM,0 μM, 0.625 μM,1.25 μM,2.5 μM,5 μM,10 μM,20 μM,20 μM的浓度注入芯片Fc1、2通道,结合解离时间分别为30 s。抗体与受体FcγRIII(CD16a,176Phe)亲和力测定时,将1 μg/mL的FcγRIII捕获于Fc2通道,抗体浓度分别为0 nM,0 nM,125 nM,250 nM,500 nM,1,000 nM,2,000 nM,2,000 nM,结合解离时间分别为45 s;抗体与受体FcγRIII(CD16a,176Val)亲和力测定时,将1 μg/mL的FcγRIII捕获于Fc2通道,抗体浓度分别为0 nM,0 nM,31.25 nM,62.5 nM,125 nM,250 nM,500 nM,500 nM,结合解离时间分别为60 s;抗体与受体FcγRIII(CD16b)亲和力测定时,将2 μg/mL的CD16b捕获16s于Fc2通道上,抗体浓度分别为0 nM,0 nM,625 nM,1,250 nM,2,500 nM,5,000 nM,1,000 nM,20,000 nM,20,000 nM,结合解离时间分别为30 s。抗体与受体FcRn亲和力测定时,使用pH 6.0和pH 7.4的HBS-EP+缓冲溶液,首先将2 μg/mL的FcRn捕获20 s于Fc2通道上,将抗体以0 nM,0 nM,31.25 nM,62.5 nM,125 nM,250 nM,500 nM,500 nM的浓度上样,结合解离时间分别为60 s,最后使用pH 1.5甘氨酸盐酸对芯片进行再生30 s。
每种受体捕获时间的不同主要取决于所需的捕获量,由RL计算公式所得;抗体浓度梯度的选择以及与受体结合解离时间的不同主要根据抗体和受体的相互作用性质决定,前期已经对捕获受体的量、抗体不同浓度梯度的选择、结合解离时间进行了预实验和条件摸索。在正式测试时,样品置于Rack 1与96孔板中。针对不同的受体,供试抗体和阳性抗体采用相同的浓度梯度进样比较,具体浓度梯度数值详见上述。
四、数据分析
进样结束后使用Biacore T200 Evaluation Software进行数据分析,扣除空白浓度和Fc1通道的背景信号后进行数据拟合,针对不同的结合解离性质,采用1:1 binding模型或affinity稳态分析模型。
实验注意要点
- 实验前进行系统检测(System Check)
- 进行实验前需要执行System Check,保证仪器各项功能和参数都处于“Pass”状态。
- 偶联anti-his抗体的量和捕获量
- 本实验按照偶联anti-his抗体、捕获Fc受体、抗体与受体的结合、抗体与受体的解离以及芯片表面的再生的步骤进行。Anti-his抗体在Fc1、Fc2通道的偶联量要基本一致,每个循环中捕获带有His标签蛋白的相应值RU要稳定,如果捕获量处于持续升高的状态,要注意缓冲体系中P20的浓度是否过低;再生液的选择要严格,如果抗体受体复合物没有完全再生下来,会影响抗体和受体结合时产生的信号值。
- 样品、缓冲液配置
- 生物类似药的评价极其严格,对样品制备的要求极高,稀释的样品浓度必须准确,稀释过程中样品避免沾到管壁上、避免产生气泡,进样过程中为防止样品微量挥发,必须盖有封膜,否则都会影响相似性评价。另外,实验所需缓冲液建议现配现用。
- 本实验未设置阴性对照
- 本实验未设置阴性对照,原因如下:(1)分析的供试抗体和阳性抗体前期已经通过预实验反复验证与受体有特异性结合;(2)参比通道的信号未见有非特异性吸附或信号降低的趋势,表明抗体流经捕获受体的通道Fc2,产生的结合信号扣减掉参比通道Fc1,即Fc 2-1产生的信号是特异性的结合信号;(3)在预实验中分析供试抗体、阳性抗体与受体FcRn的结合解离性质时,在缓冲体系为pH 6.0条件下供试抗体、阳性抗体与受体FcRn有结合信号;而在缓冲体系为pH 7.4条件下,供试抗体、阳性抗体与FcRn均无结合信号,这符合理论结果,同时也验证该体系稳定,没有假阳性干扰,因此无需设置阴性对照。
结果与数据分析
- Anti-his抗体的偶联结果
为保证Anti-his Fc1、Fc2通道上偶联量一致,我们采用Wizard中的目标偶联法,将anti-his抗体偶联量设为6,000 Ru,根据上述结果,Fc1(A)、Fc2(B)通道的偶联量达到要求(图4)。

图4 Fc1(A)、Fc2(B)通道偶联Anti-his抗体过程图
- 供试抗体、阳性抗体与受体的亲和力分析结果
本实验使用Biacore T200进行供试抗体、阳性抗体与受体CD64(FcγRI)的亲和力分析(图5、表1),根据抗体与受体结合、解离的性质,使用1:1 binding模式进行拟合,结果显示,供试抗体、阳性抗体与受体CD64(FcγRI)的亲和力值非常接近,分别为2.541E-09M(图5A)和2.799E-09M(图5B),而且其供试抗体与受体CD64(FcγRI)的结合常数5.096E+05(1/M.s),解离常数为1.295E-03(1/s),结合、解离性质相似。
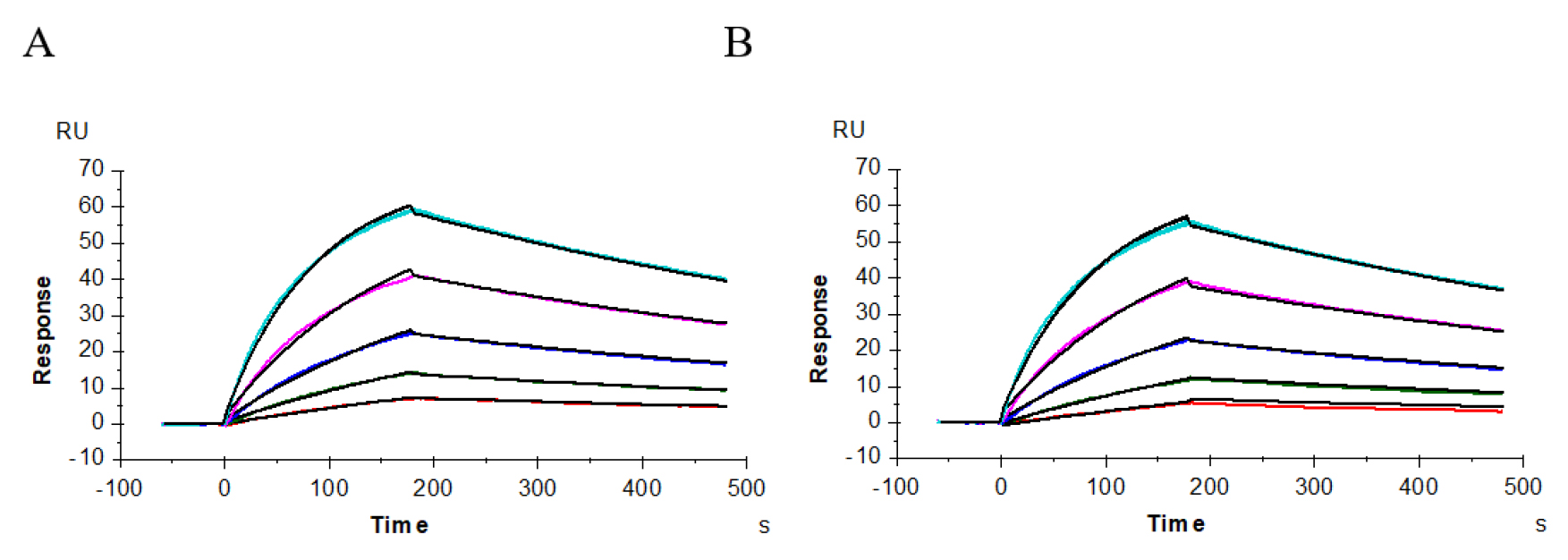
图5 供试抗体(A)、阳性抗体(B)与受体CD64(FcγRI)的亲和力分析
表1 样品与受体FcγRI(CD64)的亲和力测定结果
| 抗体 | Fc受体 | ka(1/M.s) | kd(1/s) | KD(M) |
| 供试抗体 | FcγRI
(CD64) | 5.096E+05 | 1.295E-03 | 2.541E-09 |
| 阳性抗体 | 4.758E+05 | 1.332E-03 | 2.799E-09 |
图6–8显示了供试抗体、阳性抗体与受体CD32a(FcγRIIa,167His)、CD32a(FcγRIIa,167Arg)、CD32b(FcγRIIb)的结合、解离性质,其结合模式为快上快下型,我们采用Affinity模式进行拟合。表2结果显示,供试抗体、阳性抗体与受体CD32a(FcγRIIa,167His)的亲和力值分别为3.146E-06M(图6A、B)、3.185E-06M(图6C、D);与受体CD32a(FcγRIIa,167 Arg)亲和力值分别为4.786E-06M(图7A、B)、4.116E-06M(图7C、D);与受体CD32b(FcγRIIb)亲和力值分别为1.169E-05M(图8A、B)、1.178E-05M(图8C、D),二者比较亲和力值都非常接近。
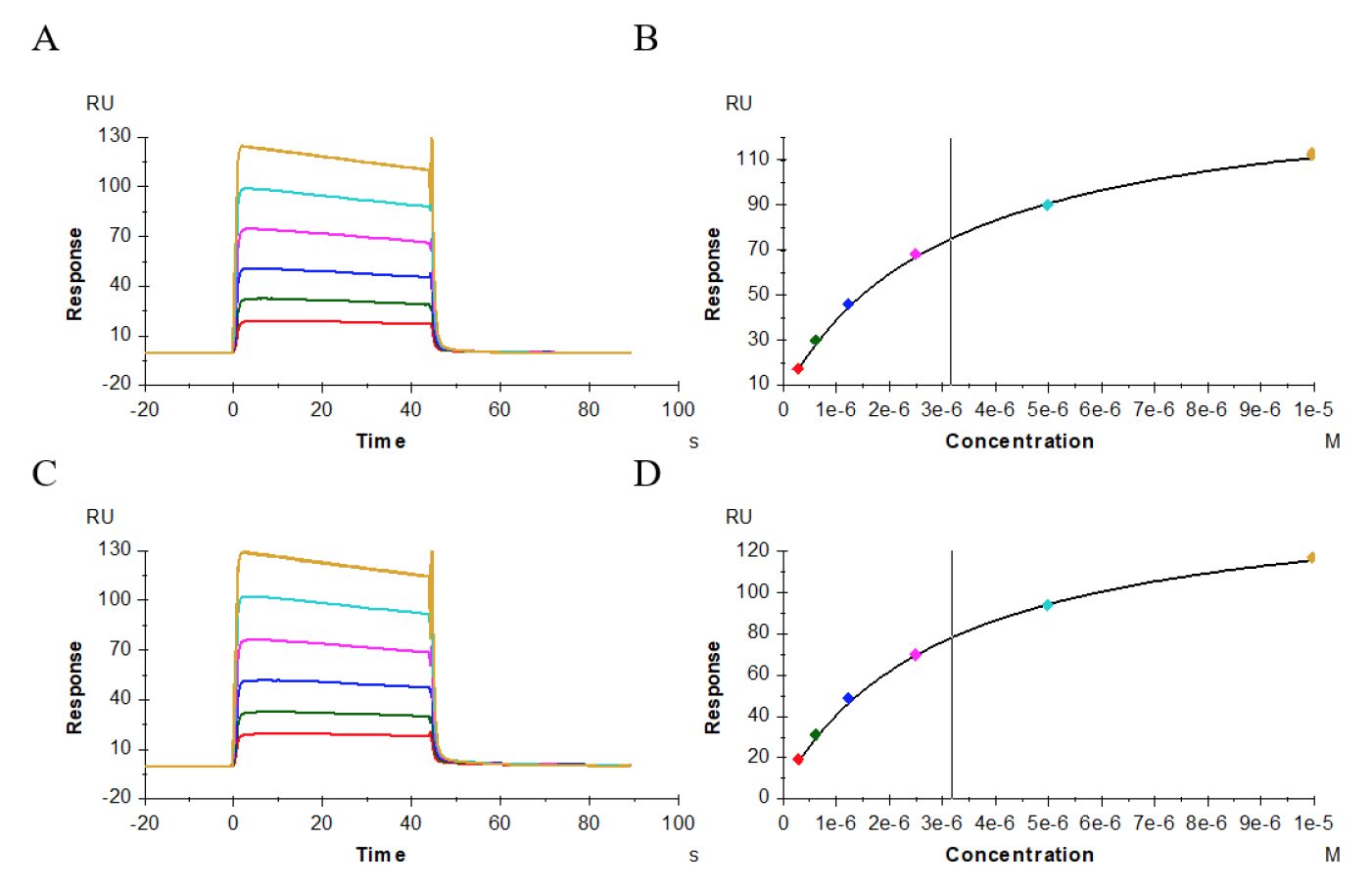
图6 供试抗体(A、B)、阳性抗体(C、D)与受体CD32a(FcγRIIa,167His)的亲和力分析
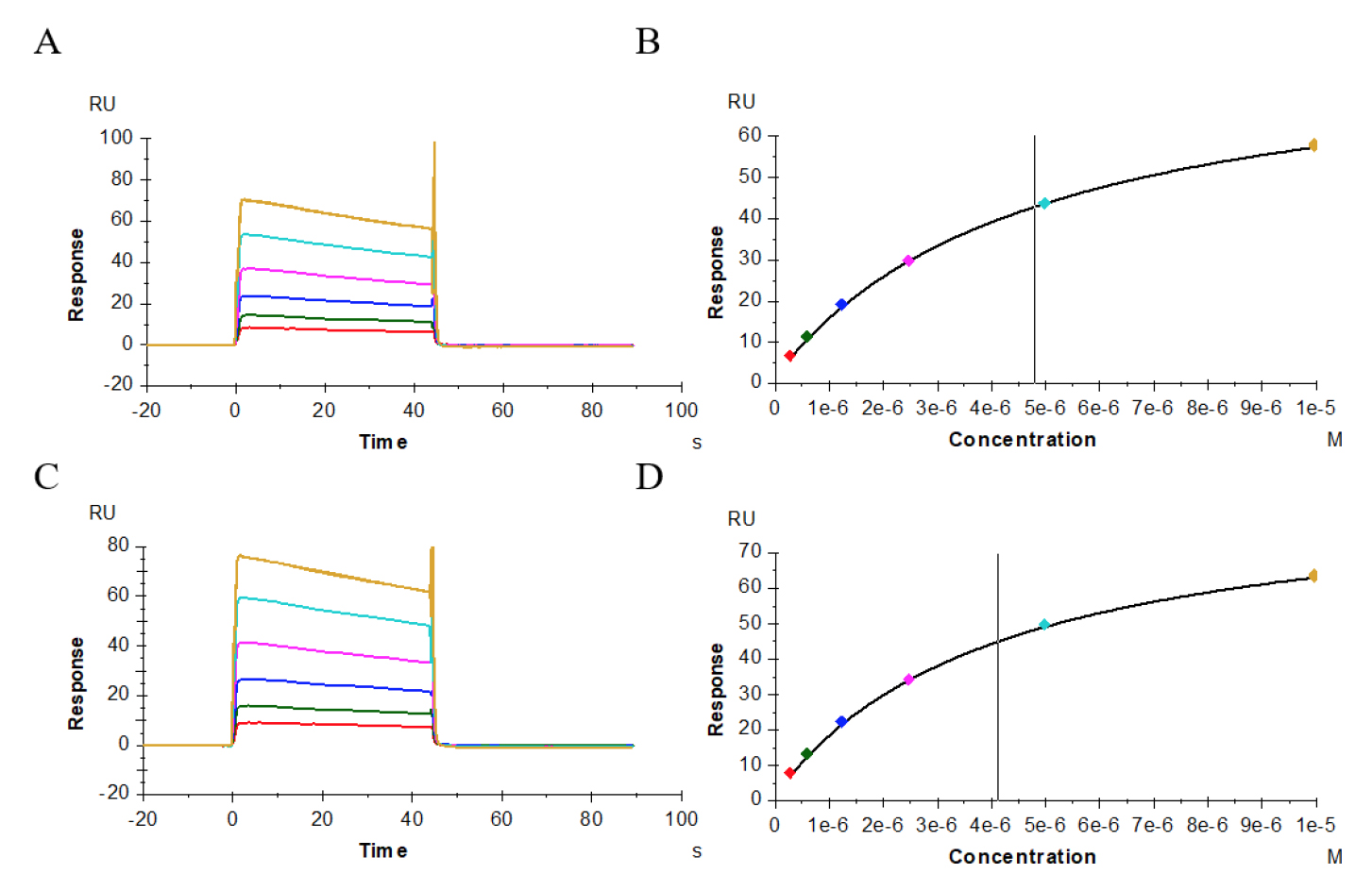
图7 供试抗体(A、B)、阳性抗体(C、D)与受体CD32a(FcγRIIa,167Arg)的亲和力分析
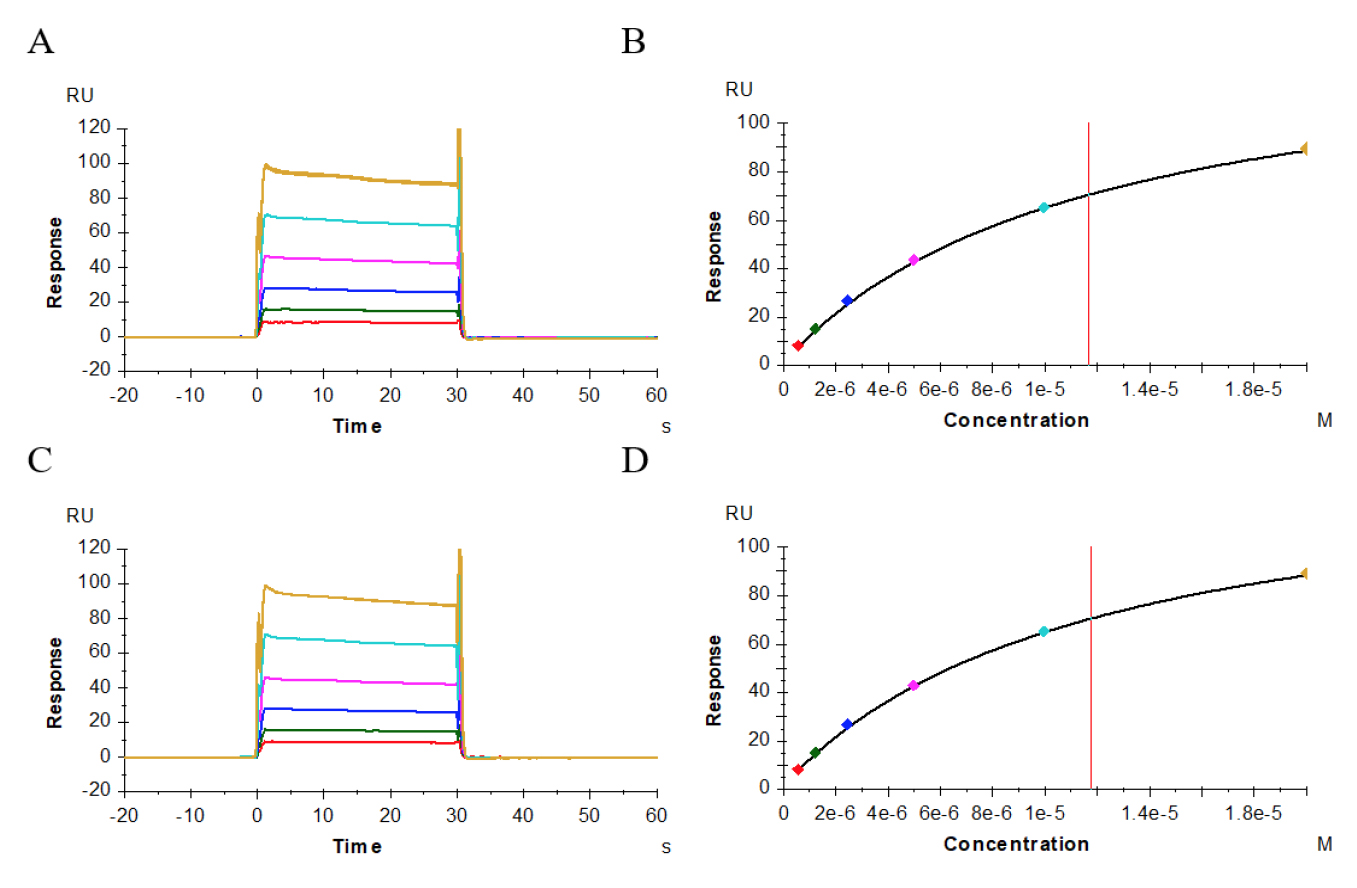
图8 供试抗体(A、B)、阳性抗体(C、D)与受体CD32b(FcγRIIb)的亲和力分析
表2 样品与受体FcγRII(CD32a, 167His;CD32a, 167Arg)的亲和力测定结果
| 抗体 | Fc受体 | ka(1/M.s) | kd(1/s) | KD(M) |
| 供试抗体 | FcγRIIa
(CD32a, 167His) | NA | NA | 3.146E-06 |
| 阳性抗体 | NA | NA | 3.185E-06 |
| 供试抗体 | FcγRIIa
(CD32a, 167Arg) | NA | NA | 4.786E-06 |
| 阳性抗体 | NA | NA | 4.116E-06 |
| 供试抗体 | FcγRIIb
(CD32b) | NA | NA | 1.169E-05 |
| 阳性抗体 | NA | NA | 1.178E-05 |
(注NA: not applicable)
通过对供试抗体、阳性抗体与受体FcγRIII(CD16a,176Phe)、FcγRIII(CD16a,176Val)、FcγRIII(CD16b)的相互作用进行了分析,图9–11显示了其结合解离的性质,表3显示其结合常数、解离常数和亲和力值。供试抗体、阳性抗体与受体FcγRIII(CD16a,176Phe)的结合解离情况的传感图为图9A、9B,其亲和力值分别为1.893E-06M、1.669E-06M;与FcγRIII(CD16a,176Val)的结合解离情况的传感图为图10A、10B,亲和力值分别为2.745E-07M、2.526E-07M;与FcγRIII(CD16b)的结合解离情况的传感图为图11A-B、11C-D,亲和力值分别为1.377E-05M、1.374E-05M。上述所测结果显示,供试抗体和阳性抗体与受体FcγRIII的动力学常数基本一致。
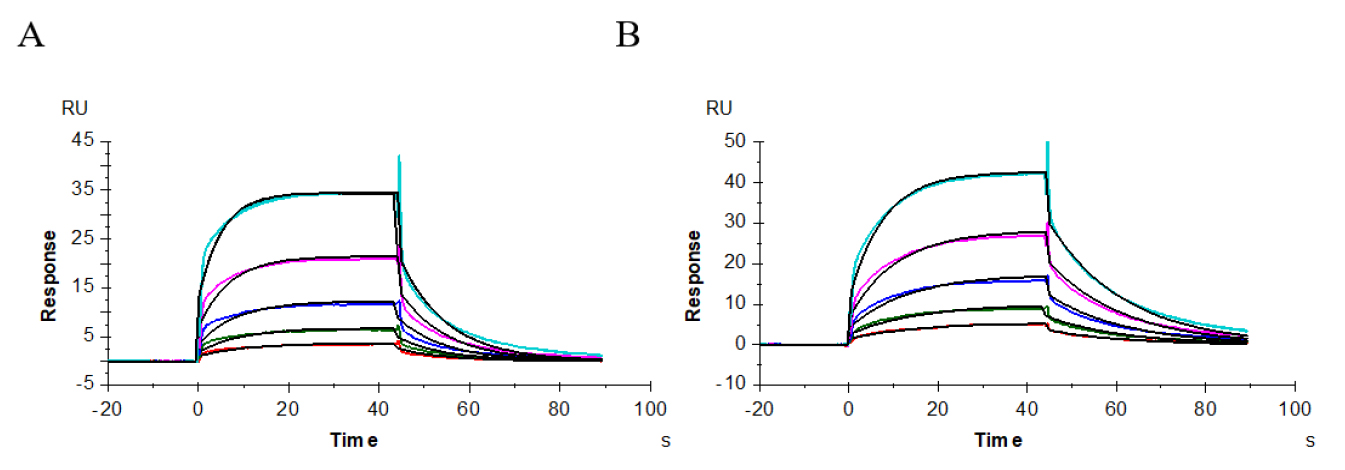
图9 供试抗体(A)、阳性抗体(B)与受体CD16a(FcγRIII,176Phe)的亲和力分析
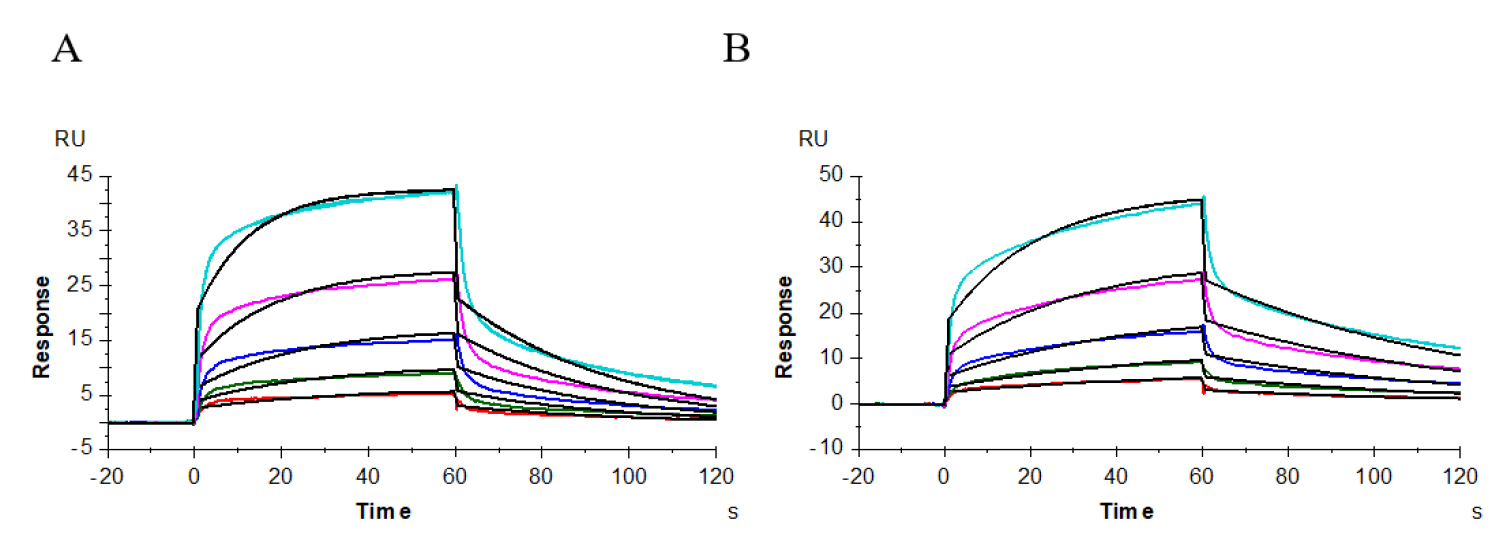
图10 供试抗体(A)、阳性抗体(B)与受体CD16a(FcγRIII,176Val)的亲和力分析
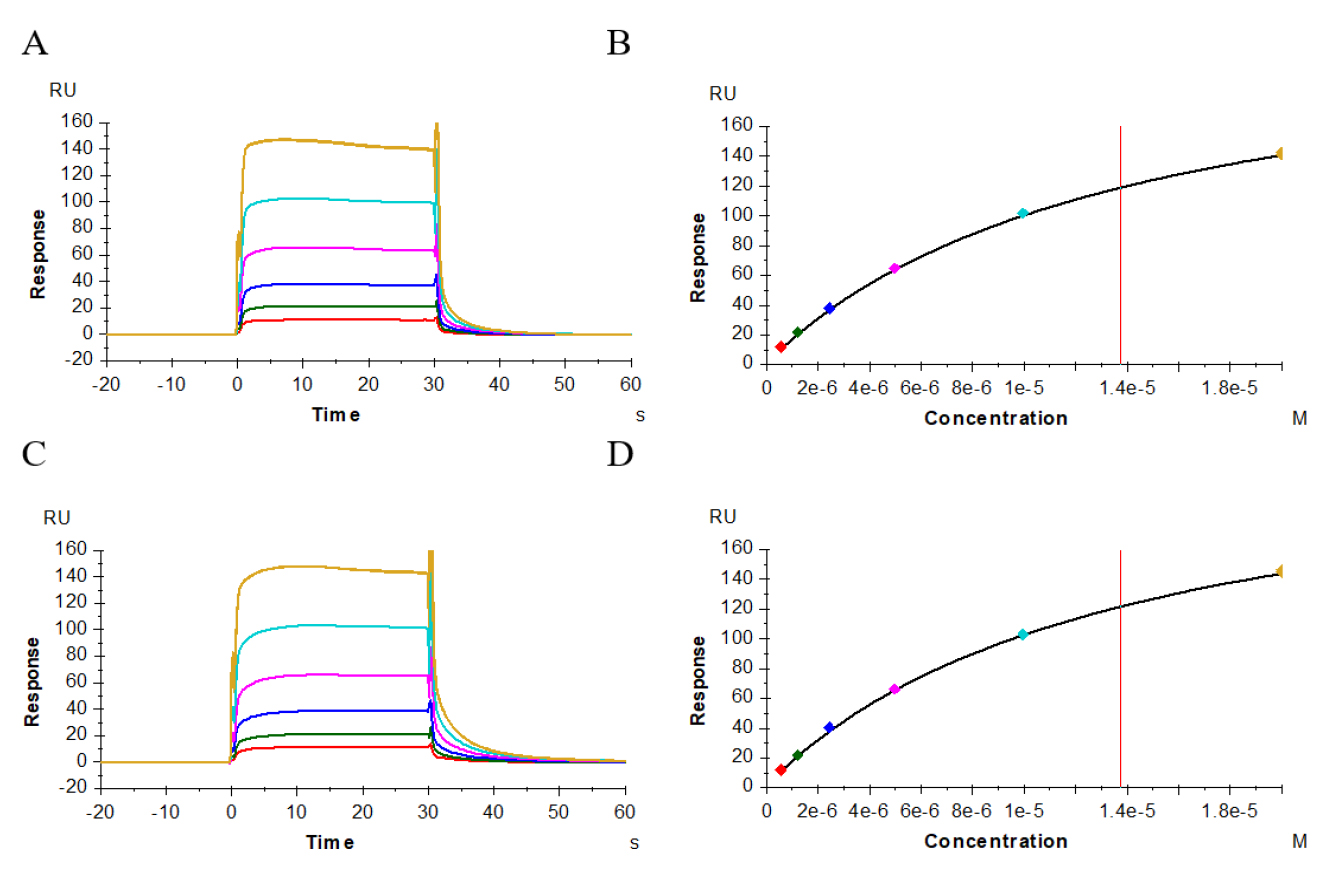
图11 供试抗体(A、B)、阳性抗体(C、D)与受体CD16b(FcγRIII)的亲和力分析
表3 样品与受体FcγRIII(CD16a, 176Phe;CD16a, 176Val;FcγRIII(CD16b))的亲和力测定结果
| 抗体 | Fc受体 | ka(1/M.s) | kd(1/s) | KD(M) |
| 供试抗体 | FcγRIIIa
(CD16a, 176Phe) | 5.001E+04 | 9.467E-02 | 1.893E-06 |
| 阳性抗体 | 3.505E+04 | 5.849E-02 | 1.669E-06 |
| 供试抗体 | FcγRIIIa
(CD16a, 176Val) | 1.026E+05 | 2.817E-02 | 2.745E-07 |
| 阳性抗体 | 6.211E+04 | 1.569E-02 | 2.526E-07 |
| 供试抗体 | FcγRIIIb
(CD16b) | NA | NA | 1.377E-05 |
| 阳性抗体 | NA | NA | 1.374E-05 |
(注NA: not applicable)
FcRn具有保护IgG抗体的功能,从而延长抗体的半衰期。抗体在血液中被内皮细胞或单核细胞摄取后,与FcRn在酸性(pH 6–6.5)的内体中结合,不被溶酶体降解,之后抗体受体复合物又被转运至细胞表面,在生理环境(pH 7.4)条件下,抗体与FcRn解离,重新释放至组织间液或血液,继续发挥其中和抗原的活性。
因此,我们分析了缓冲体系为pH 6.0和7.4的条件下,供试抗体、阳性抗体与受体FcRn的结合解离性质,其结果显示(图12、表4),在缓冲体系为pH 6.0条件下供试抗体与阳性抗体与受体FcRn的结合解离情况为图12A、12C,亲和力值分别为4.425E-07M、4.470E-07M,结合、解离性质相近;在缓冲体系为pH 7.4条件下供试抗体、阳性抗体与FcRn均不结合(图12B、12D)。上述结果说明供试抗体与阳性抗体在延长抗体的半衰期方面具有生物等效性。
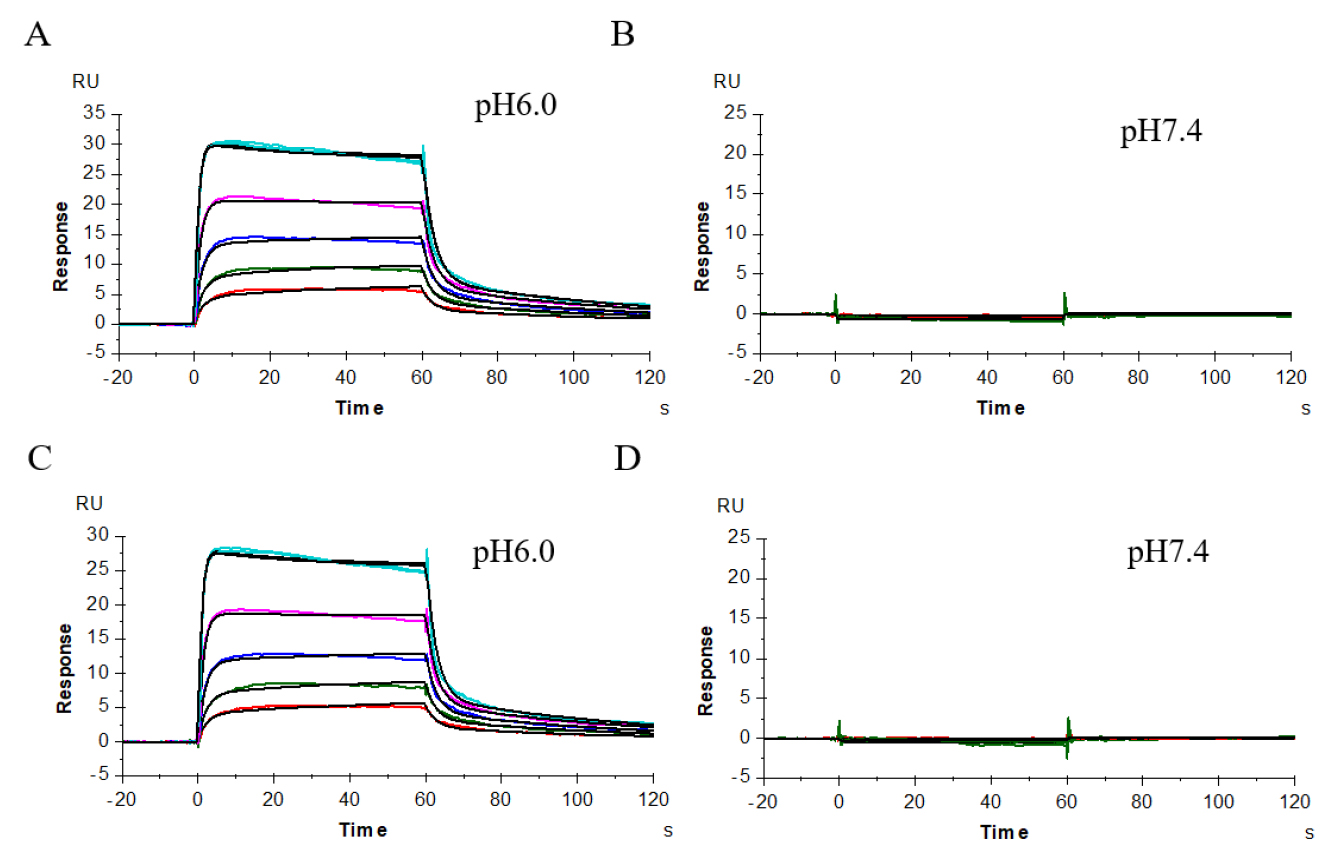
图12 供试抗体(A、B)、阳性抗体(C、D)与受体FcRn在pH 6.0和pH 7.4条件下的亲和力分析
表4 样品与受体FcRn(缓冲液pH 6.0、7.4)的亲和力测定结果
| 抗体 | Fc受体 | ka(1/M.s) | kd(1/s) | KD(M) | 备注 |
| 供试抗体 | FcRn | 7.270E+05 | 3.217E-01 | 4.425E-07 | 缓冲液pH 6.0;
各抗体最高浓度500 nM |
| 阳性抗体 | 7.987E+05 | 3.570E-01 | 4.470E-07 |
| 供试抗体 | NA | NA | NA | 缓冲液pH 7.4;
各抗体最高浓度500 nM |
| 阳性抗体 | NA | NA | NA |
(注NA: not applicable)
上述实验结果显示,供试抗体和阳性抗体的Fc段与相应受体结合、解离的性质、亲和力基本一致,初步说明它们在发挥抗体的ADCC效应、ADCP效应、延长半衰期方面具有相似性,具体的生物学功能需要其他方法进一步验证。
溶液配方
- HBS-EP+ 缓冲液
取50 mL 购置的10× HBS-EP+ 缓冲液,加入到450 mL超纯水中,配制为1× HBS-EP+ 的缓冲液,建议现配现用。 - 供试抗体和阳性抗体的配制
将供试抗体和阳性抗体用1× HBS-EP+ 的缓冲液梯度稀释至所需浓度。
致谢
本实验数据依托复旦大学药学院仪器测试中心的Biacore T200设备产生,数据所有权归东曜药业有限公司,经协商,该公司允许提供上述实验数据,在此表示感谢!本论文只用来提供Biacore方法学参考,不涉及利益冲突。
参考文献
- BiacoreTM T200 Instrument Handbook, GE Healthcare Life Science, USA.
- 生物类似药研发与评价技术指导原则(试行),2015年,中国。
- Accurate comparability assessment of a biosimilar interferon in process development, GE Healthcare Life Science, USA.
Copyright: © 2023 The Authors; exclusive licensee Bio-protocol LLC.
引用格式:曹忠莲, 周维, 张弛, 杨萍. (2023). 重组人源化抗VEGF单抗生物类似药与Fc受体的亲和力分析. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011004. DOI:
10.21769/BioProtoc.1011004.
 How to cite:
How to cite: Cao, Z. L., Zhou, W., Zhang, C. and Yang, P. (2023). Affinity Analysis of Recombinant Humanized Anti-VEGF Biosimilars with Fc Receptors. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011004. DOI:
10.21769/BioProtoc.1011004.
