摘要: 虾是我国重要的水产养殖物种。其中,由于高密度集约化养殖的快速发展,近年来加剧了南美白对虾细菌性疾病的发生,从而造成了水产养殖行业严重的经济损失。因此,研究病原菌的致病性和致病机理,对于有效控制南美白对虾养殖业中病原菌的爆发具有重要的意义。本文介绍了病原菌侵染对虾的两种实验方法,包括模拟自然条件的浸浴及注射侵染。这为研究病原菌对南美白对虾的致病机制提供了技术方法支持。
关键词: 南美白对虾, 致病菌, 浸浴侵染, 注射侵染
材料与试剂
- Marine broth 2216E培养基(海博生物,目录号:HB0132-1)
- PBS缓冲液(生工,目录号:E607020)
- 75%酒精(沪试,目录号:80176961)
- 无菌研磨杵(生工,目录号:F619072)
- 无菌手术剪(生工,目录号:F519233)
- 无菌镊子(生工,目录号:F519022)
- 1 mL无菌注射器(王冠)
- 无菌水
- 海水
仪器设备
- 多功能酶标仪(BioTek,型号:Cytation5M)
- 超净工作台(海尔,型号:HCB-1300V)
- 恒温培养箱(上海博迅,型号:BXP-280)
- 气泵(海利,型号:ACO-9730)
- 养殖缸(定制,亚克力玻璃)
- PCR仪(Thermo Fisher,型号:4375305)
- 离心机(Eppendorf,型号:Eppendorf 5420)
实验步骤
一、致病菌的分离与鉴定
- 虾肠道组织取样: 在爆发大规模南美白对虾死亡的养殖区域广泛收集死亡南美白对虾。通常细菌感染对虾后,会大量聚集在肠道组织中。因此,将收集完的南美白对虾置于无菌操作台上,用蘸有75%酒精的无菌棉擦拭虾体。用无菌手术剪沿虾线部位剪开虾背(如图1所示),用镊子取出对虾肠道组织,并置于含有200 μL 1× PBS缓冲液的无菌1.5 mL离心管中备用。
- 致病细菌的分离与纯化: 用无菌研磨杵对肠道组织进行研磨,在肠道组织充分破碎后释放组织内的细菌。随后,使用无菌海水将上述研磨液进行梯度稀释(101、102、103、104、105、106、107),并涂布于marine broth 2216E固体培养基平板上,于28 ℃恒温培养箱中培养96小时。要注意的是,虽然目前大部分的对虾致病菌,如弧菌,发光杆菌,假单胞菌等,都可以使用marine broth 2216E进行培养,但其并非对所有对虾致病菌都适用。因此在分离对虾致病菌时,可以使用多种培养基,以分离培养更多样化的潜在致病菌。待菌落长出后,用无菌接种环挑取不同颜色形态的单菌落,于marine broth 2216E固体培养基平板上进行细菌的分离培养,将单菌落进行连续9–10次的传代后获得纯化菌株。
- 致病细菌的物种鉴定:从marine broth 2216E固体培养基平板上挑取单菌落作为PCR扩增的模板。对于细菌的鉴定,采用细菌16S rRNA基因的通用引物,为27F: 5’-AGAGTTTGATCCTGGCTCAG-3’和1492R: 5’-GGTTACCTTGTTACGACTTC-3’。PCR扩增体系(25 μL)包含:15 μL Q5 2× Master Mix (NEB)、1 µL F/R引物、8 μL无菌水和致病菌的单菌落。PCR扩增程序为:98 ℃预变性30 s;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃终延伸2 min。将扩增后的产物送往生工生物工程有限公司进行Sanger测序。将测序获得的16S rRNA基因序列在RDP classifier和NCBI数据库中进行检索比对,对分离的细菌进行物种分类。通过物种注释与进一步的基因组分析,将本实验中从对虾肠道中分离得到的一株致病菌LvS-8n3,命名为Photobacterium damselae subsp. damselae LvS-8n3.
二、致病菌的侵染实验
- 致病细菌生长量确定:将纯化后的致病菌P. damselae subsp. damselae LvS-8n3单菌落接种到5 mL marine borth 2216E液体培养基中,于28 ℃摇床中培养96小时。使用多功能酶标仪在595 nm波长下测定致病细菌培养菌液的吸光度值。将菌液进行梯度稀释(101、102、103、104、105、106、107)并均匀涂布在marine borth 2216E固体培养基平板上,置于28 ℃恒温培养箱中培养48小时。对上述平板进行菌落计数,并计算1 mL菌液中的菌落形成单位(CFU/mL)。
- 侵染实验中致病细菌菌液制备:根据所需的细菌细胞浓度制备菌液。将致病细菌按上述条件进行培养24 h后,以8,000 rpm离心10 min后收集菌体,然后加入等量无菌海水重悬后备用。
- 南美白对虾的养殖:从厂里取回对虾后首先置于大体系的养殖水体(100 L养殖缸内含80 L无菌海水)中进行稳定养殖。养殖条件为盐度30‰、pH 7.5–8.0、温度28 ± 2 ℃、溶解氧> 5 mg/L。每天早中晚喂食无菌饵料三次,投饵量为对虾体重的5%。待对虾达到稳定的生存状态时,即可进行侵染实验。
- 细菌侵染实验:
- 浸浴侵染实验:随机选择30只同等规格的南美白对虾分别置于两个30 L养殖缸中(内含25 L无菌海水)。实验分为对照组和侵染组,每组设置三个平行。将制备好的实验菌液按3*108 CFU/mL加入到侵染组对虾养殖水体中并混匀[1](如图2所示),对照组添加等量的无菌海水。实验期间控制养殖条件为盐度30‰、pH 7.5–8.0、温度28 ± 2 ℃、溶解氧> 5 mg/L。每天早中晚喂食无菌饵料三次,投饵量为对虾体重的5%。每天更换养殖缸中全部海水并吸出残余的饵料和对虾粪便,同时为侵染组对虾添加新鲜的实验菌液。每隔12小时记录两组对虾的死亡数量,直到对虾达到稳定的存活状态,从而制作致病细菌侵染后一定时间内,南美白对虾的存活率曲线。另外,实验结束后取两组对虾的肠道和肝胰腺进行固定,可随后用于扫描电镜和组织病理切片染色等实验,进一步观察致病菌造成的组织损伤状态。
- 注射侵染实验:随机选择30只同等规格的南美白对虾分别置于两个30 L养殖缸中(内含25 L无菌海水)。实验分为对照组和侵染组,每组设置三个平行。用1 mL无菌注射器吸取40 μL菌液(浓度为3*108 CFU/mL),对侵染组南美白对虾腹部第三肌节处进行注射[2](如图3所示)。对照组对虾注射等量的无菌海水。实验期间控制养殖条件为盐度30‰、pH 7.5–8.0、温度28 ± 2℃、溶解氧> 5 mg/L。每天早中晚喂食无菌饵料三次,投饵量为对虾体重的5%。每天更换养殖缸中全部海水,并吸出残余的饵料和对虾粪便。每隔12小时记录两组对虾的死亡数量,直到对虾达到稳定的存活状态,从而制作致病细菌侵染后一定时间内,南美白对虾的存活率曲线。另外,实验结束后取两组对虾的肠道和肝胰腺进行固定,可随后用于扫描电镜和组织病理切片染色等实验,进一步观察致病菌造成的组织损伤状态。
- 侵染后对虾状态:与健康南美白对虾相比,侵染致病细菌后,南美白对虾的活动能力下降,随后死亡。细菌侵染后死亡对虾呈现出不同的状态,如尾部、足部和触须变红,肠道呈现完全空肠的状态,肝胰腺组织裂解等(如图4所示)。

图1. 南美白对虾肠道和肝胰腺的解剖及取样

图2. 致病细菌对南美白对虾的浸浴侵染实验
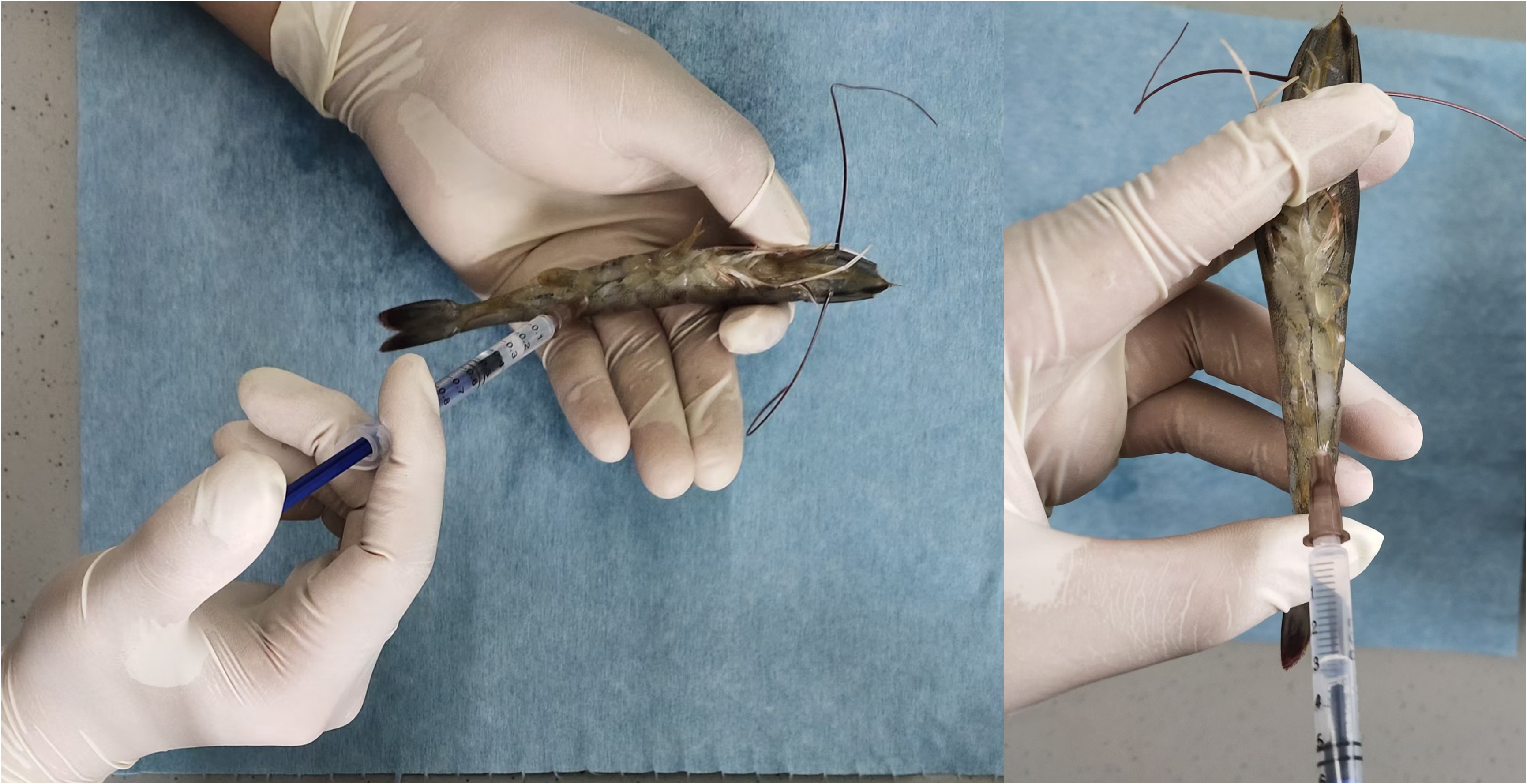
图3. 致病细菌对南美白对虾的注射侵染实验

图4. 致病细菌对南美白对虾的侵染表型
溶液配方
- Marine broth 2216E培养基
称取Marine broth 2216E培养基粉末37.4克,溶解在1000 mL蒸馏水中,121 ℃高压灭菌20分钟,冷却备用。 - 无菌水
取100 mL蒸馏水,121℃高压灭菌20分钟,冷却备用。
参考文献
- Gao, N., Shu, Y., Wang, Y., Sun, M., Wei, Z., Song, C., Zhang, W., Sun, Y., Hu, X., Bao, Z., et al. (2024). Acute Ammonia Causes Pathogenic Dysbiosis of Shrimp Gut Biofilms. Int J Mol Sci. 25(5): 2614. https://doi.org/10.3390/ijms25052614
- Joshi, J., Srisala, J., Truong, V. H., Chen, I. T., Nuangsaeng, B., Suthienkul, O., Lo, C. F., Flegel, T. W., Sritunyalucksana, K., Thitamadee, S., et al. (2014). Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture: 297–302. https://doi.org/10.1016/j.aquaculture.2014.03.030
Copyright: © 2024 The Authors; exclusive licensee Bio-protocol LLC.
引用格式:王永明, 丁维. (2024). 虾的致病菌侵染实验. // 微生物组实验手册.
Bio-101: e1011015. DOI:
10.21769/BioProtoc.1011015.
 How to cite:
How to cite: Wang, Y. M. and Ding, W. (2024). Experiment on the infection of pathogenic bacteria in Shrimp. // Microbiome Protocols eBook.
Bio-101: e1011015. DOI:
10.21769/BioProtoc.1011015.
