材料与试剂
- His-TrpRS和His-avitag (biotin)-TrpRS委托北京义翘神州科技有限公司合成
- Surfactant P20(产品目录号:BR100054)
- 10× HEPES-P(产品目录号:BR100671)和10× PBS-P(产品目录号:28-9950-84)缓冲溶液购自于美国Cytiva公司
- 1 M Tris缓冲溶液(产品目录号:MC030.1)购自于中科迈晨(北京)商贸有限公司
- 3 M NaCl水溶液(935418)购自于北京百灵威科技有限公司
- 腺苷 5'-三磷酸盐(ATP)(产品目录号:A7699)和腺苷 3'-单磷酸盐(AMP)(产品目录号:A9272)购自于美国Sigma-Aldrich公司
- 1 M PIPES水溶液(产品目录号:C4870),1 M MgCl2水溶液(产品目录号:R0481)购买于美国Amresco公司
- 吲哚霉素(产品目录号:15385)购自于美国Cayman公司
- S系列SA芯片(产品目录号:BR100531)
- 氨基偶联试剂盒(产品目录号:BR-1000-50)和NTA捕获试剂盒(产品目录号:28995056)均购置于美国Cytiva公司
- 1.05× PBS-P缓冲溶液(见溶液配方)
- 1.0× 含5% DMSO 缓冲溶液(见溶液配方)
- 1.05× PBS-P缓冲溶液(含1.05 mM MgCl2)(见溶液配方)
- 1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)(见溶液配方)
- 1.05× PBS-P缓冲溶液(含1.05 mM ATP)(见溶液配方)
- 1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM AMP)(见溶液配方)
- 1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2)(见溶液配方)
- 1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)(见溶液配方)
- 1.05× HBS-P缓冲溶液(含1.05 mM MgCl2)(见溶液配方)
- 1.05× HBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)(见溶液配方)
- 1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2)(见溶液配方)
- 1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)(见溶液配方)
仪器设备
- 表面等离子共振仪(美国Cytiva公司,Biacore T200 & 8K)
实验步骤
一、NTA芯片捕获His-TrpRS,表征TrpRS与吲哚霉素的结合
- 实验前的准备
(1)打开Biacore T200系统和电脑的电源开关。Biacore T200的电源开关位于系统背面的右下角。开机后,需等待检测单元的温度达到预设温度(用户自设,通常为25 °C)。待温度稳定后,面板上的温度指示灯(黄色)会停止闪烁,该过程可能需要30~60分钟。
(2)打开Biacore T200 Control Software,将软件程序和主机系统建立连接。
(3)准备偶联步骤的运行缓冲溶液。量取20 mL 10× PBS-P缓冲溶液、180 mL去离子水(已完成0.22 μm膜过滤处理),混匀后放入缓冲溶液瓶。
(4)将配制好的缓冲溶液放在T200系统左侧的缓冲溶液托架上,换上黑色的单孔盖。
(5)将缓冲溶液进液管A(注意软管上的蓝色标签)插入至缓冲溶液瓶底部。其余三根进液管(B、C和D)放在左侧的舱门后。
(6)将2 L的废液瓶放置在T200系统右侧的缓冲溶液托架上,连接上专用的盖子。
(7)取500 mL去离子水装入500 mL缓冲溶液瓶,放置在右侧缓冲溶液托架上用于清洗进样针。
(8)选择Tools菜单中的Eject Chip选项,打开芯片舱门进行芯片更换(图1)。
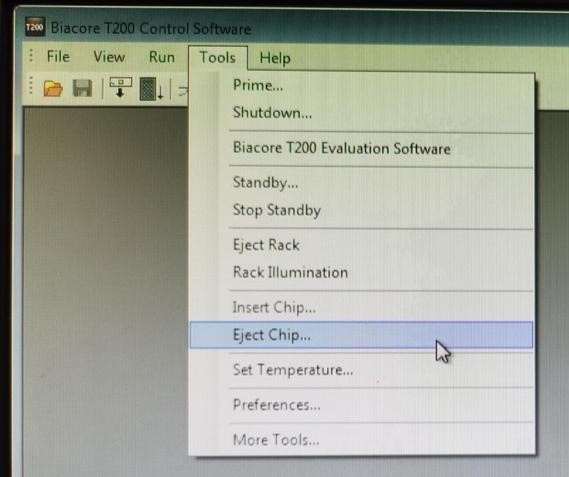
图1 芯片更换选项所在位置
(9)若使用的是新芯片,则选择New chip(图2)。在Chip type的下拉菜单中选择对应的芯片种类(此实验为NTA芯片),在Chip id中填入和芯片相关的实验信息,Chip lot no.中可填入芯片批号(选填)。若是已经使用过的芯片,请选择Reuse Chip,并在Chip id下拉菜单中找到与之相对应的芯片信息。对于使用过的芯片,也可以选择New chip选项,则之前芯片的使用信息不会被查询到。
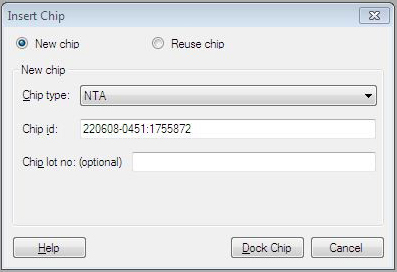
图2 芯片类型选择窗口
(10)手持芯片,有字的一面朝上。按照芯片上的箭头方向,将芯片轻轻推入卡槽,合上芯片舱的舱门。
(11)点击Dock Chip按钮,芯片置入后系统将自动转入待机(Standby)状态。
(12)选择Tools → Prime命令,点击Start。缓冲溶液会以较高的流速冲洗整个内部流路系统,耗时6–7分钟。结束后,点击Close,系统自动转入待机(Standby)状态。
注意:当系统更换缓冲溶液或者芯片后,必须运行Prime程序。Prime时缓冲溶液会冲洗整个流路系统,为下一步的实验做好准备。 - 配体的偶联
(1)偶联量计算。根据下式1可计算目标偶联量:
其中,Rmax为芯片表面的理论最大结合响应,TrpRSMW和吲哚霉素MW分别为蛋白和小分子的分子量,SL为化学计量比,未知时选择1。RL为小分子偶联水平。实验时实际偶联量为1.5 RL。若固定RL为10 RU,则经计算,Rmax为1,000 RU,TrpRS的目标偶联量为1,000 RU。
注意:若已知蛋白和小分子的结合化学计量数,则按照实际情况填写。若未知,考虑绝大多蛋白和小分子结合的化学计量数为1,可暂且默认为1。同时,考虑部分蛋白固定于芯片后,由于空间位阻和固定取向的原因,会导致部分蛋白不能结合目标小分子,为了保证小分子的结合响应数值,可以依据式1计算数值后,多固定些蛋白,以1.5倍为宜。具体调整倍数,可以根据第一次实验结果后自行调整。
(2)点击Run下面的Manual Run,Flow rate在本次实验中选择10 µl/min,选择Flow path 2(Flow path的选择可以根据芯片的实际使用情况来选择),右侧下拉菜单中选用Sample and Reagent Rack 1(Biacore T200有三种不同的试管架可根据用户实际情况自行选择使用:Reagent Rack 1、Reagent Rack 2和Sample and Reagent Rack1。),点击Start,输入文件名称保存(图3)。
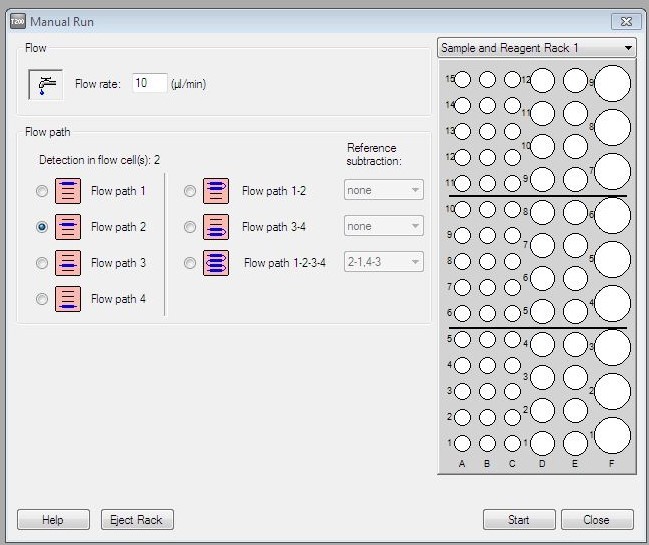
图3 Manual Run程序的建立以及流路通道和流速的选择窗口
(3)点击Eject rack tray,弹出试管架,依次将100 μL 350 mM EDTA放入R1D1,100 μL 0.5 mM NiCl2放入R1D2以及200 μL 30 ng/μL TrpRS放入R1D3(若使用的是带盖的EP管,所有盖子必须剪去)。盖上试管架盖子,点击Eject Rack Tray对话框中的OK,将样品架送回样品舱。
注意:样品舱舱门打开后会有时间限制,打开60秒后舱门将自动关闭。最后15秒时,对话框中的倒数计时会显示为红色字体并闪烁。此时请不要强行将试管架放入,以免夹到手。可以等待舱门合上后,重新打开即可。
(4)点击inject,Vial/well position选择R1D1,Contact time输入60 s,使用350 mM EDTA溶液冲洗芯片表面(图4);继续点击inject,Vial/well position选择R1D2,Contact time输入60 s,在NTA芯片表面螯合镍离子,此时基线会上升约40 RU;继续点击inject,Vial/well position选择R1D3,Contact time输入30 s,开始固定TrpRS,注射TrpRS的过程可以以脉冲的方式,重复操作,直至达到预计固定量。
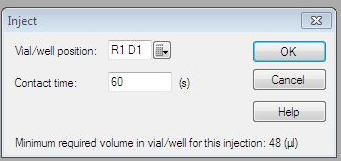
图4 进样位置和时间的填写窗口
二、NTA芯片联合氨基偶联完成His-TrpRS的固定,表征TrpRS与吲哚霉素的结合
由于NTA传感器芯片带有未修饰的羧甲基基团,可以与CM系列传感器芯片采用相同的方式用于共价固定,因此可以在0.5 mM NiCl2注射之后和30 ng/μL TrpRS注射之前用0.2 M N-乙基-N9-(3-二甲基氨基丙基)碳二亚胺(EDC)和0.05 M N-羟基琥珀酰亚胺(NHS)的混合溶液活化NTA传感器芯片,进而通过共价偶联固定TrpRS。与单独使用镍离子捕获的固定方法相比,镍离子螯合结合氨基偶联的固定方法可以产生更高的TrpRS固定水平和更稳定的基线,并且比单纯的氨基偶联固定方法更容易获得趋向一致的TrpRS。
- 配体的偶联
(1)TrpRS的偶联。由于使用的仍为NTA芯片,缓冲溶液仍为PBS-P缓冲溶液,因此可以延续第一部分内容,在此基础上直接进行TrpRS的偶联。
(2)点击Run下面的Manual Run,Flow rate输入10 μL/min,选择Flow path 1–2(Flow path的选择可以根据芯片的实际使用情况来选择),右侧下拉菜单中选用Sample and Reagent Rack 1,点击Start,输入文件名称保存。
(3)点击Eject rack tray,弹出试管架,依次将100 μL 350 mM EDTA放入R1D1,100 μL 0.5 mM NiCl2放入R1D2,200 μL 0.2 M EDC/0.05 M NHS混合液放入R1D3,200 μL 30 ng/μL TrpRS放入R1D4以及200 μL 1M乙醇胺 (EA) 放入R1D5。盖上试管架盖子,点击Eject Rack Tray对话框中的OK,将样品架送回样品舱。
注意:EDC/NHS混合液需要在15分钟内完成上样。
(4)点击Flow path command,选择Flow path 2,点击inject,Vial/well position选择R1D1,Contact time输入60 s,使用350 mM EDTA冲洗芯片表面;继续点击inject,Vial/well position选择R1D2,Contact time输入60 s,在NTA芯片表面螯合镍离子,此时基线会上升约40 RU;点击Flow path command,选择Flow path 1–2,继续点击inject,Vial/well position选择R1D3,Contact time输入420 s,开始活化NTA芯片表面;点击Flow path command,选择Flow path 2,点击inject,Vial/well position选择R1D4,Contact time输入30 s,开始固定TrpRS(重复R1D4位置的进样,直至TrpRS达到预计固定量);点击Flow path command,选择Flow path 1–2,继续点击inject,Vial/well position选择R1D5,Contact time输入420 s,对于未偶联TrpRS的羧基开始进行封闭。
注意:Flow path的选择可以根据芯片的实际使用情况来选择。若1和2通道已经被使用,可以选择Flow path 3–4;若同时固定三种蛋白,则可选择Flow path 1–2–3–4。 - 样品制备以及上机检测
(1)配制运行缓冲溶液和溶剂校正曲线。因为吲哚霉素的储液为DMSO溶液,因此吲哚霉素的运行缓冲溶液选用含5% DMSO的PBS-P溶液(视样品溶解性可调整DMSO含量,最高DMSO含量不能超过固定蛋白的耐受度)。取52.5 mL 10× PBS-P用去离子水(已完成0.22 μm膜过滤处理)稀释到500 mL,配成1.05× PBS-P。然后,取出380 mL 1.05× PBS-P缓冲溶液和20 mL DMSO(已完成0.22 μm膜过滤处理)混匀,制备1.0× 含5% DMSO的PBS-P 缓冲溶液,随后按照表1所示,制备DMSO含量为4.5%、4.9%、5.3%以及5.8%的溶剂校正曲线(4点校正)。(表1)
表1. DMSO的4点溶剂校正曲线配制方法
| 4.5% DMSO | 5.8 % DMSO | | 4.9% DMSO | 5.3% DMSO |
| 1.05× PBS-P | 9.5 mL | 9.5 mL | 4.5% DMSO | 3 mL | 1.5 mL |
| DMSO | 0.45 mL | 0.58 mL | 5.8 % DMSO | 1.5 mL | 3 mL |
| 最终体积 | ~10 mL | ~10 mL | 最终体积 | 4.5 mL | 4.5 mL |
(2)吲哚霉素浓度梯度的配制。首先,使用DMSO将10 mM吲哚霉素稀释至4 mM,然后,使用1.05× PBS-P溶液稀释4 mM小分子母液20倍,得到终浓度为200 μM的含有5% DMSO的吲哚霉素溶液,随后,用配好的1.0× 含5% DMSO的PBS-P缓冲溶液2倍稀释11个浓度梯度,例如100 μM,50 μM,25 μM,12.5 μM,6.25 μM,3.125 μM,1.56 μM,0.78 μM,0.39 μM(可根据实际样品的亲和力强弱进行梯度调整)。以1.0× 含5% DMSO的PBS-P缓冲溶液作为零浓度。
(3)多循环动力学/亲和力分析程序设置。本实验选用多循环检测(multi-cycle kinetic/affinity),首先,将缓冲溶液进液管A插入的缓冲溶液更换为1.0× 含5% DMSO的PBS-P缓冲溶液,点击Biacore T200 Control Software里Tools下拉菜单中的Prime,然后点开Run下面的Wizard,选择Kinetics/affinity,点击New。
(4)在Injection Sequence界面,Flow path选择2–1,Chip type选择Custom(因这里选择NTA芯片,会在每一个浓度梯度之前重复进行镍离子螯合和TrpRS固定的步骤,而在前面的步骤中为了克服单独镍离子螯合TrpRS基线不稳定的问题,我们使用镍离子螯合联合氨基偶联的方式完成了TrpRS的固定,所以这里直接选择Custom芯片进行吲哚霉素浓度梯度的上样即可),勾选Sample和Carry Over,点击Next(图5)。
注意:Carry Over是使用50% DMSO溶液冲洗管路,目的是为了避免样品上一个浓度在管路里的残留影响下一个样品的浓度。若实验体系不含DMSO等有机溶剂,可以不勾选Carry Over。Regeneration根据实验体系的实际情况勾选,一般蛋白和小分子的互作体系不需要芯片再生。
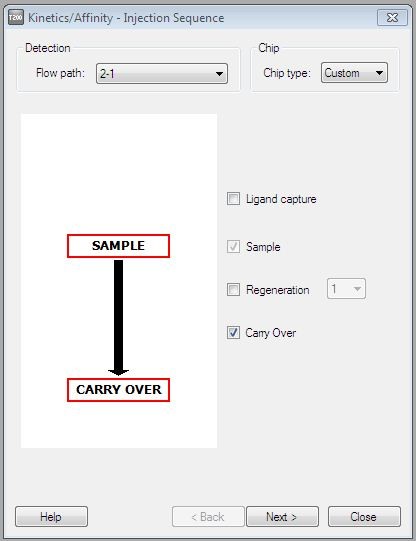
图5. 流路通道、芯片种类和实验流程的参数设置
(5)在Setup界面,勾选Run startup cycles,Solution输入PBS-P, 5% DMSO,Number of cycles选择5;勾选Run solvent correction, Number of injections选择4,Repeat after 100 sample cycles, 点击Next(图6)。

图6. Conditioning、Startup和溶剂校正的参数设置
(6)在Injection Parameters界面,Contact time输入60 s,Flow rate输入30 μL/min,Dissociation time输入120 s,Extra wash after injection with输入50% DMSO,Stabilization period输入30 s,点击Next(图7)。
注意:这里的结合、解离时间可以根据实验体系的实际情况自行设置。Stabilization period是指两个样品的进样间隔,通常在30–60 s之间。
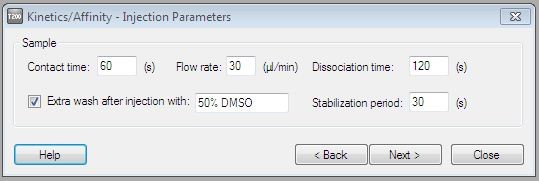
图7. 多循环动力学/亲和力分析程序建立过程中结合解离时间和流速等的设置
(7)在Samples界面,输入吲哚霉素的Sample id以及浓度梯度(通常为浓度由低到高输入,8–12个浓度梯度即可),Run order选择As entered,点击Next(图8)。
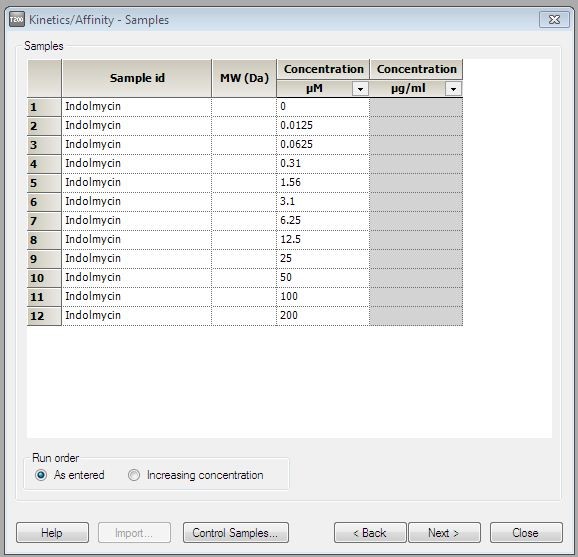
图8. 多循环动力学/亲和力分析程序建立过程中流动相浓度梯度的设置
(8)点击弹出框中的Ignore按钮,在System Preparation界面,勾选Prime before run,实验温度一般为25 °C,点击Next。
(9)在Rack Positions界面,将左侧Reagent Rack改为Sample and Reagent Rack1,点开Menu后选择Automatic Positioning进入下个界面后,将Pooling一栏全部改为Yes,Vial Size可根据需求进行调整,若使用1.5 mL EP管,则选择medium(图9和图10)。
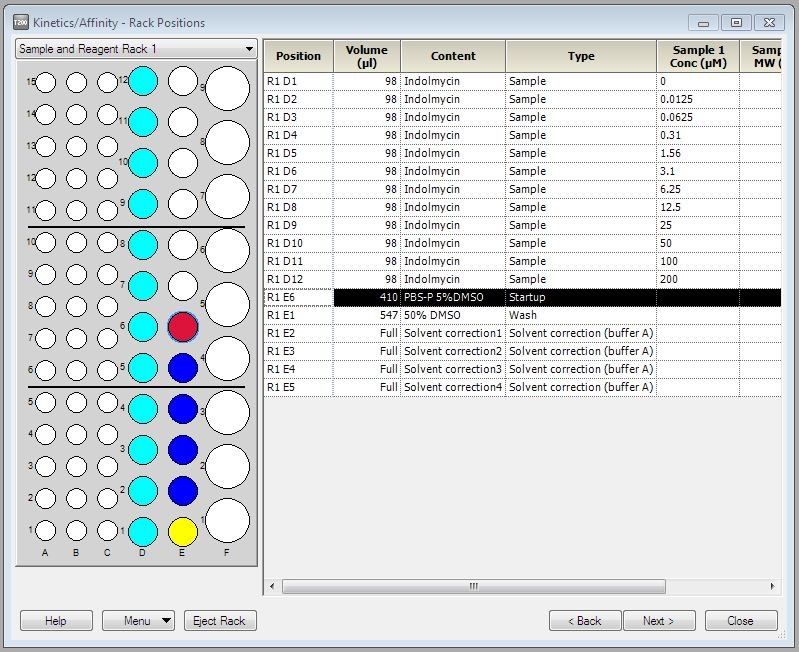
图9. 样品体积的要求以及放置位置的参数设置
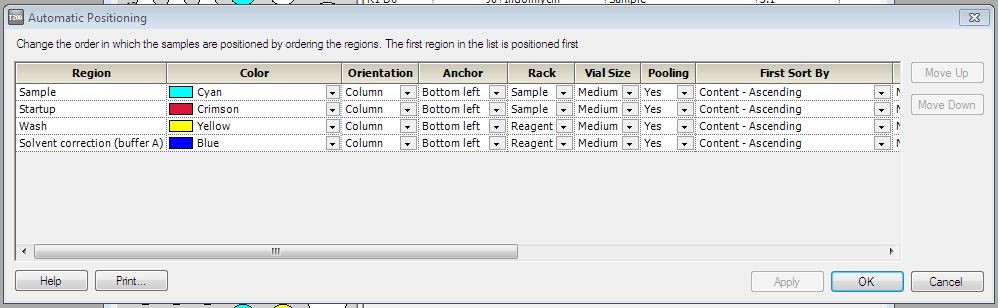
图10. 多循环动力学/亲和力分析程序建立过程中样品管类型的设置
(10)根据样品所在位置进行样品准备和放置,盖好橡胶瓶盖防止挥发。点Next后,对方法和数据结果进行保存,仪器便会开始自动运行。 - 数据分析与数据解析
(1)打开数据分析软件Biacore T200 Evaluation Software,点击File中的open找到运行文件。
(2)首先点Solvent Correction进行溶剂校正分析(图11)。溶剂校正曲线一般要求落在-500到+1000 RU之间,Chi2小于2。如果超出此范围较多,一般是由于DMSO浓度配制不准确造成。
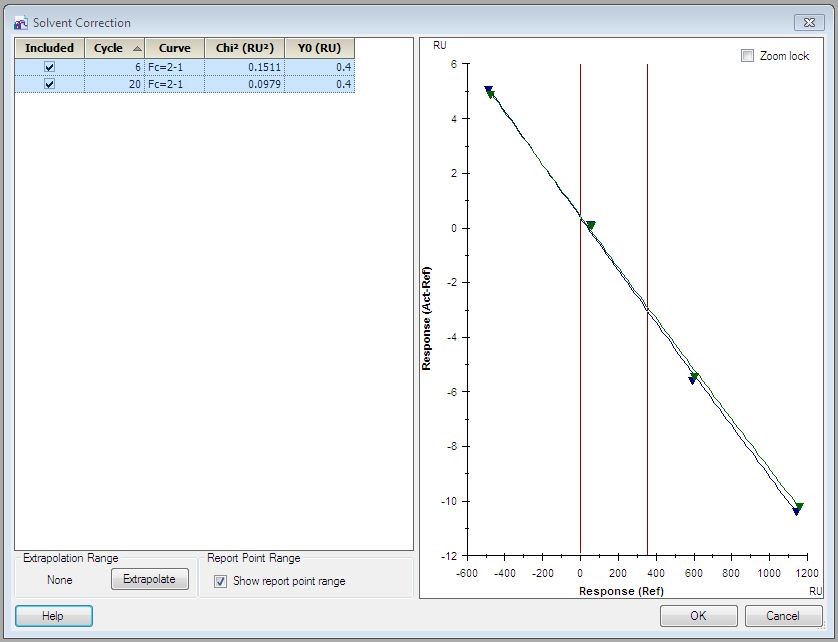
图11. 溶剂校正曲线
(3)点击Kinetics/Affinity下的Surface bound进行拟合(图12)。小分子因亲和力较弱,多数没有动力学曲线,因此常选用Affinity拟合。亲和力较强且有动力学曲线的小分子可选用Kinetics模型拟合。选择要分析的样品,在Included一栏中可以选择待分析的样品浓度。若样品某个浓度的检测结果不合适,可以将此浓度前的对号勾掉,以删除此浓度,点击Next,选择Affinity,进行亲和力拟合,继续点击Next。
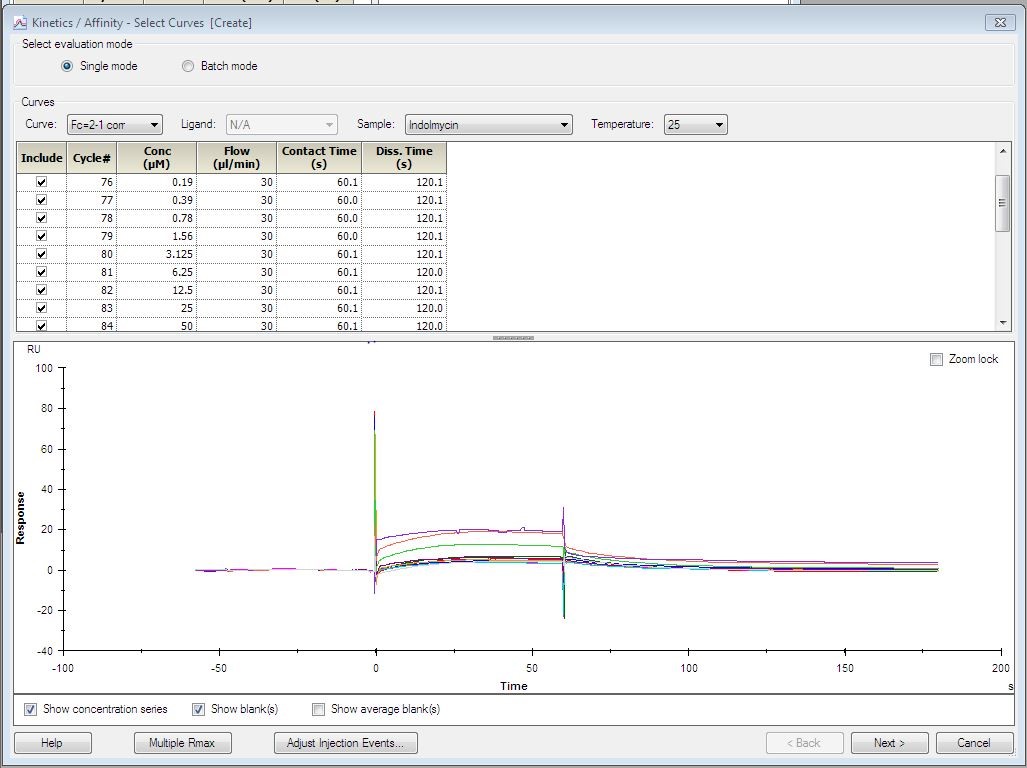
图12. 小分子化合物的结合解离曲线和对应浓度
(4)接着点左上角的Fit即可得到拟合结果(图13)。
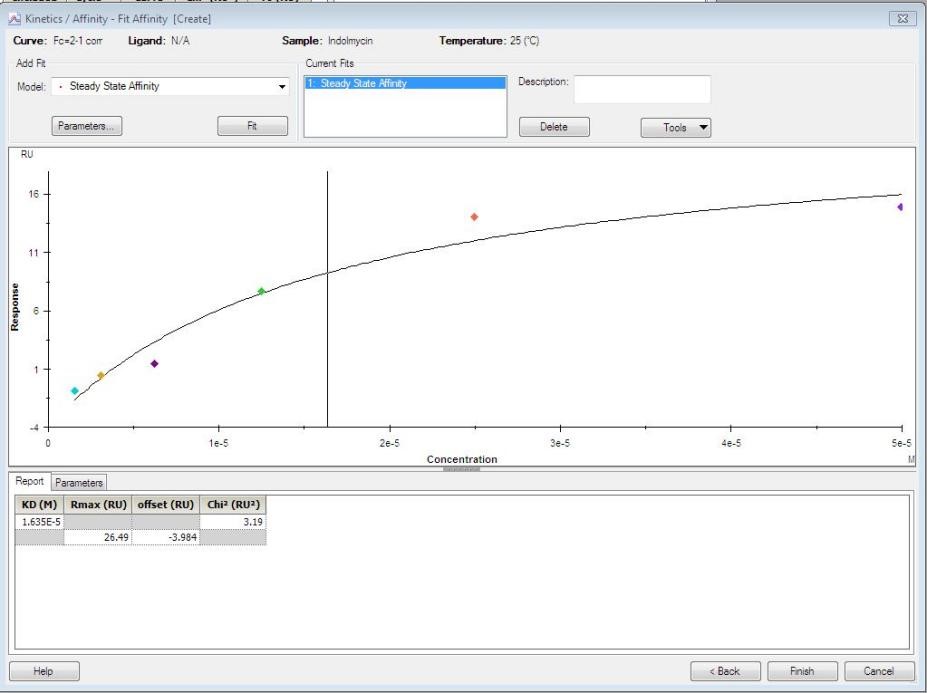
图13. 小分子亲和力拟合实验结果
三、SA芯片固定His-avitag (biotin)-TrpRS,表征TrpRS与吲哚霉素的结合
- 实验前的准备
(1)缓冲溶液的配制和放置。准备偶联步骤的运行缓冲溶液。量取52.5 mL 10×PBS-P缓冲溶液,使用去离子水(已完成0.22 µm膜过滤处理)定容至500 mL,配制1.05×PBS-P缓冲溶液,混匀后放入缓冲溶液瓶。
(2)准备亲和力检测过程中的缓冲溶液。量取285 mL 1.05×PBS-P缓冲溶液,加入15 mL DMSO(已完成0.22 µm膜过滤处理),混匀,配制1.0×含5% DMSO的PBS-P缓冲溶液。
(3)将已经配制好的1.05×PBS-P缓冲溶液放在T200系统左侧的缓冲溶液托架上,换上黑色的单孔盖,将缓冲溶液进液管A(注意软管上的蓝色标签)插入至缓冲溶液瓶底部。其余三根进液管(B、C和D)放在左侧的舱门后。废液瓶和去离子水瓶的放置同实验步骤第一部分《1. 实验前的准备》中的内容。
(2)SA芯片的放置。具体步骤同实验步骤第一部分《1. 实验前的准备》中的内容。 - 配体的偶联
(1)点击Biacore T200 Control Software菜单栏中的Run,下拉菜单选择Wizard,点击immobilization,点击New(图14)。
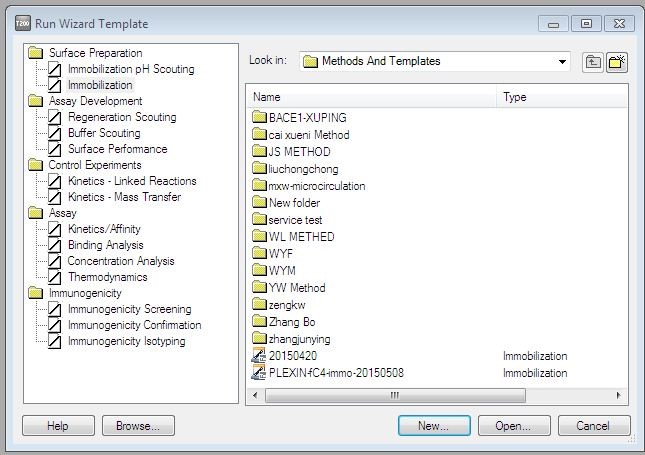
图14. SA芯片固定生物素化蛋白时偶联方法的建立
(2)在Immobilization Setup界面,Chip type中选SA,Flow cells per cycle选1。勾选Flow cell 2,method选用SA-biotin capture,Ligand输入TrpRS,该实验选用Aim for immobilized level,Target level输入1000 RU(图15)。接着按Next,勾选prime,选择实验温度,一般默认25 °C。
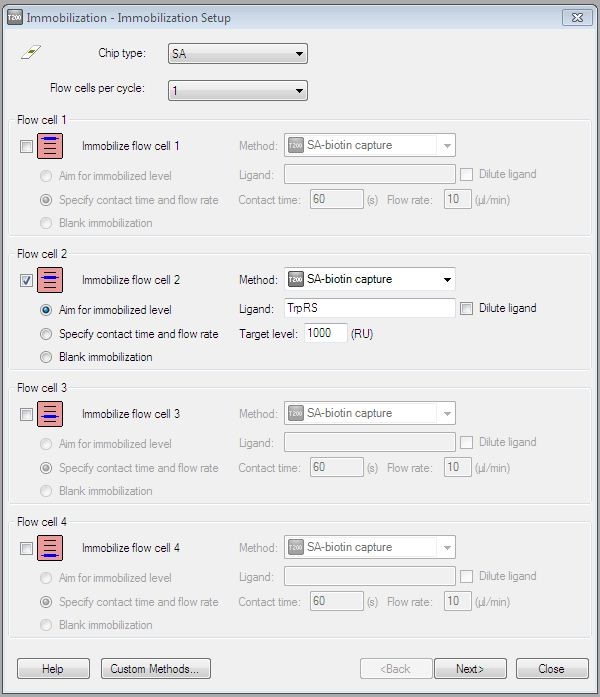
图15. SA芯片固定生物素化蛋白时系统方法中各参数的设置界面
(3)在左侧下拉菜单中选用Sample and Reagent Rack 1,系统会自动排好样品放置位置(也可以通过鼠标拖拽重新安排)(图16)。根据样品架位置表,准备足够体积的样品(同样,若使用的是带盖的EP管,所有盖子必须剪去)。114 μL的1 M NaCl, 50 mM NaOH放入R1D1,148 μL的TrpRS放入R1D2,61 μL 50% Isopropanol/50 mM NaOH/1 M NaCl放入R1D3。盖上试管架盖子,将样品架送回样品舱。
注意:为防止吸空或者体积不够,一般会比系统要求体积至少多加10 μL。
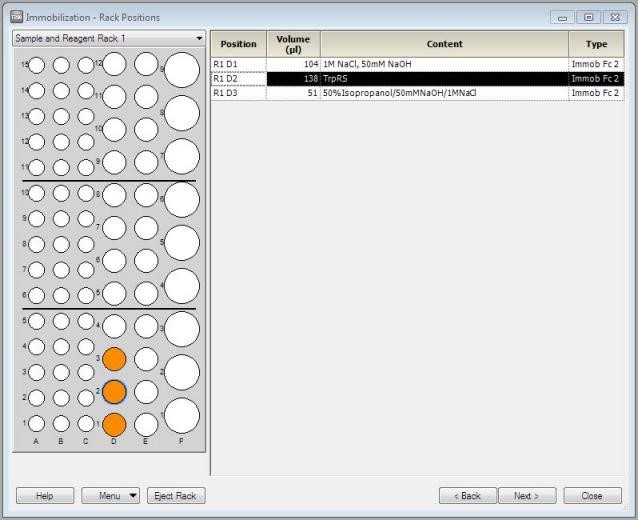
图16. 生物素化蛋白偶联过程中对样品体积的要求以及放置位置的设置
(4)保存method与result文件到文件夹。系统正式自动运行偶联程序,整个过程耗时约30 min。软件自动生成偶联结果。 - 样品制备以及上机检测
(1)配制运行缓冲溶液和溶剂校正曲线。运行缓冲溶液和溶剂校正曲线的配制同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。
(2)吲哚霉素浓度梯度的配制。吲哚霉素浓度梯度的配制同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。
(3)多循环动力学/亲和力分析程序设置。多循环动力学/亲和力分析程序的设置同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。 - 数据分析与数据解析
TrpRS与吲哚霉素亲和力数据结果分析同实验步骤第二部分《3. 数据分析与数据解析》中的内容。
四、SA芯片固定His-avitag (biotin)-TrpRS,表征TrpRS与吲哚霉素在不同PBS-P缓冲溶液条件中的结合,优化结合体系
- 实验前的准备
(1)准备偶联步骤的运行缓冲溶液。量取21 mL 10× PBS-P缓冲溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,制备1.05× PBS-P缓冲溶液,混匀后放入缓冲溶液瓶。
(2)准备亲和力检测过程中的缓冲溶液。量取21 mL 10× PBS-P缓冲溶液以及210 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。量取21 mL 10× PBS-P缓冲溶液,210 μL 1 M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL ,配制1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。量取21 mL 10×PBS-P缓冲溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液(含1.05 mM ATP),混匀后放入缓冲溶液瓶。量取21 mL 10× PBS-P缓冲溶液,210 μL 1 M MgCl2水溶液以及420 μL 500 mM AMP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM AMP),混匀后放入缓冲溶液瓶。分别量取152 mL的上述四种1.05× 缓冲溶液,分别加入8 mL DMSO(已完成0.22 µm膜过滤处理),混匀,配置1.0× 含5% DMSO的四种缓冲溶液。
(3)将已经配制好的用于偶联运行步骤的1.05× PBS-P缓冲溶液放在T200系统左侧的缓冲溶液托架上,换上黑色的单孔盖,将缓冲溶液进液管A(注意软管上的蓝色标签)插入至缓冲溶液瓶底部。其余三根进液管(B、C和D)放在左侧的舱门后。废液瓶和去离子水瓶的放置同实验步骤第一部分《1. 实验前的准备》中的内容。
(4)SA芯片的放置。芯片的放置同实验步骤第一部分《1. 实验前的准备》中的内容。 - 配体的偶联
His-avitag (biotin)-TrpRS的偶联同实验步骤第三部分《2. 配体的偶联》中的内容。若使用已经固定了His-avitag (biotin)-TrpRS的SA芯片,则可以忽略此步骤。
- 样品制备以及上机检测
(1)配制运行缓冲溶液和溶剂校正曲线。运行缓冲溶液和溶剂校正曲线的配制同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。因有四种不同的PBS-P缓冲溶液条件,因此需要配制四组不同的运行缓冲溶液以及缓冲溶液背景下的溶剂校正曲线。
(2)吲哚霉素浓度梯度的配制。吲哚霉素浓度梯度的配制同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。同样,因有四种不同的PBS-P缓冲溶液条件,因此需要配制四组不同缓冲溶液背景下的吲哚霉素的相同浓度梯度。
(3)多循环动力学/亲和力分析程序设置。多循环动力学/亲和力分析程序的设置同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。同样,因有四种不同的PBS-P缓冲溶液条件,因此需要更换缓冲溶液后,重复设置四次。 - 数据分析与数据解析
TrpRS与吲哚霉素亲和力数据结果分析。TrpRS与吲哚霉素亲和力数据结果分析同实验步骤第二部分《3. 数据分析与数据解析》中的内容。
五、SA芯片固定His-avitag(biotin)-TrpRS,表征TrpRS与吲哚霉素在PIPES-P, TRIS-P以及HBS-P缓冲溶液中的结合,继续优化结合体系
考虑到ATP的磷酸基团参与TrpRS的催化反应体系,改变缓冲溶液类型可能对TrpRS的生物活性有很大影响,因此除了PBS-P缓冲溶液,另外选用了三种不同条件的缓冲溶液:PIPES-P(10 mM PIPES, 150 mM NaCl, 0.05% 表面活性剂 P-20, pH 7.4), TRIS-P(10 mM TRIS, 150 mM NaCl, 0.05% 表面活性剂 P-20, pH 7.5)和 HBS-P(10 mM HEPES, 150 mM NaCl, 0.05% 表面活性剂 P-20, pH 7.4)继续优化TrpRS的SPR分析系统。参考PBS-P的实验条件,主要研究了MgCl2、ATP和MgCl2对吲哚霉素结合亲和力的影响。
- 实验前的准备
(1)准备偶联步骤的运行缓冲溶液。量取21 mL 10× PBS-P缓冲溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液,混匀后放入缓冲溶液瓶。若使用已经固定His-avitag (biotin)-TrpRS的SA芯片,则可以忽略此步骤。
(2)准备亲和力检测过程中的缓冲溶液。量取2.1 mL 1 M PIPES水溶液,10.5 mL 3 M NaCl水溶液,1.05 mL P20以及210 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL ,配制1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。量取2.1 mL 1 M PIPES水溶液,10.5 mL 3 M NaCl水溶液,1.05 mL P20,210 μL 1 M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL ,配制1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。量取21 mL 10× HBS-P缓冲溶液以及210 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× HBS-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。量取21 mL 10× HBS-P缓冲溶液,210 μL 1 M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL ,配制1.05× HBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。量取2.1 mL 1 M TRIS-P水溶液,10.5 mL 3M NaCl水溶液,1.05 mL P20以及210 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 µm膜过滤处理)稀释至200 mL ,配制1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。量取2.1 mL 1 M TRIS-P水溶液,10.5 mL 3 M NaCl水溶液,1.05 mL P20,210 μL 1M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。分别量取152 mL的上述六种1.05× 缓冲溶液,分别加入8 mL DMSO(已完成0.22 μm膜过滤处理),混匀,配制1.0× 含5% DMSO的六种缓冲溶液。
(3)将已经配制好的用于偶联运行步骤的1.05× PBS-P缓冲溶液放在T200系统左侧的缓冲溶液托架上,换上黑色的单孔盖,将缓冲溶液进液管A(注意软管上的蓝色标签)插入至缓冲溶液瓶底部。其余三根进液管(B、C和D)放在左侧的舱门后。废液瓶和去离子水瓶的放置同实验步骤第一部分《1. 实验前的准备》中的内容。
(4)SA芯片的放置。芯片的放置同实验步骤第一部分《1. 实验前的准备》中的内容。 - 配体的偶联
His-avitag (biotin)-TrpRS的偶联实验步骤第三部分《2. 配体的偶联》中的内容。若使用已经固定His-avitag (biotin)-TrpRS的SA芯片,则可以忽略此步骤。 - 样品制备以及上机检测
(1)配制运行缓冲溶液和溶剂校正曲线。运行缓冲溶液和溶剂校正曲线的配制同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。因有六种不同条件的缓冲溶液,因此需要配制六组不同的运行缓冲溶液以及缓冲溶液背景下的溶剂校正曲线。
(2)吲哚霉素浓度梯度的配制。吲哚霉素浓度梯度的配制同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。同样,因有六种不同条件的缓冲溶液,因此需要配制六组不同缓冲溶液背景下的相同的浓度梯度。
(3)多循环动力学/亲和力分析程序设置。多循环动力学/亲和力分析程序的设置同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。同样,因有六种不同种类的缓冲溶液条件,因此需要更换缓冲溶液后,重复设置六次。 - 数据分析与数据解析
TrpRS与吲哚霉素亲和力数据结果分析同实验步骤第二部分《3. 数据分析与数据解析》中的内容。
六、SA芯片固定His-avitag (biotin)-TrpRS,构建TrpRS与吲哚霉素在HBS-P缓冲溶液条件下的高通量筛选体系
为了测试TrpRS SPR分析系统在高通量筛选中的可行性和重复性,我们使用相应的HBS-P(7.4)缓冲溶液作为阴性对照,吲哚霉素作为阳性对照,Z因子[2] 作为指标进行评估。使用 Biacore 8K以96孔板的形式进行TrpRS SPR的筛选测定。Z因子是高通量筛选中常用的质量参数,用于确定分析方法是否可靠。Z因子等于1表示完美的分析方法,Z因子介于0.5和1之间表示是可靠的分析方法,Z因子介于0和0.5之间表示是不好的分析方法。考虑到筛选出的TrpRS抑制剂可能是ATP竞争性或非竞争性抑制剂,因此,依次研究了单独添加MgCl2和同时添加ATP和MgCl2的Z因子,MgCl2、ATP和 MgCl2缓冲溶液背景中吲哚霉素的浓度分别固定为20和1 μM。
- 实验前的准备
(1)缓冲溶液的配制和放置。准备偶联步骤的运行缓冲溶液。量取52.5 mL 10× HBS-P缓冲溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至500 mL,配制1.05× HBS-P缓冲溶液,混匀后放入缓冲溶液瓶。
(2)准备亲和力检测过程中的缓冲溶液。量取105 mL 10× HBS-P缓冲溶液以及1050 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至1,000 mL,配制1.05× 的HBS-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。量取105 mL 10× HBS-P缓冲溶液,1,050 μL 1 M MgCl2水溶液以及2.1 mL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至1,000 mL,配制1.05× HBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。量取475 mL 的上述两种1.05× HBS-P缓冲溶液,加入25 mL DMSO(已完成0.22 μm膜过滤处理),混匀,配制1.0× 含5% DMSO的两种HBS-P缓冲溶液。
(3)将已经配制好的用于偶联运行步骤的1.05× HBS-P缓冲溶液放在Biacore 8K系统右侧,换上黑色的单孔盖,将缓冲溶液进液管(注意软管上的蓝色标签)插入至缓冲溶液瓶底部。另取一个2 L的玻璃瓶,装满0.22 μm膜过滤的去离子水,换上黑色的三孔盖,将水和再生试剂的进液管(注意软管上的蓝色标签)插入至缓冲溶液瓶底部。
(4)打开Biacore 8K Control Software,选择Instrument control,点击change chip,打开芯片舱门进行芯片更换(图17)。
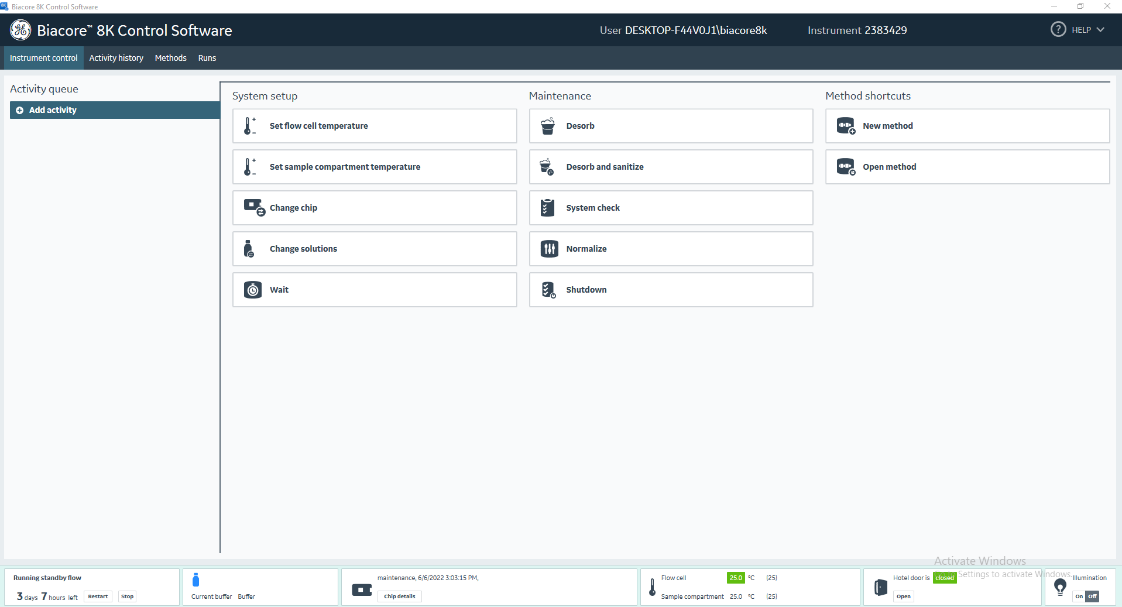
图17 软件操作界面
若使用的是新芯片,则选择New Chip(图18)。在Chip Type的下拉菜单中选择对应的芯片种类(此实验为SA芯片),在Id中填入和芯片相关的实验信息,lot Number中可填入芯片批号(选填)。若是已经使用过的芯片,请选择Used chip,并在下拉菜单中找到与之相对应的芯片信息。对于使用过的芯片,也可以选择New Chip选项,则之前芯片的使用信息不会被查询到。
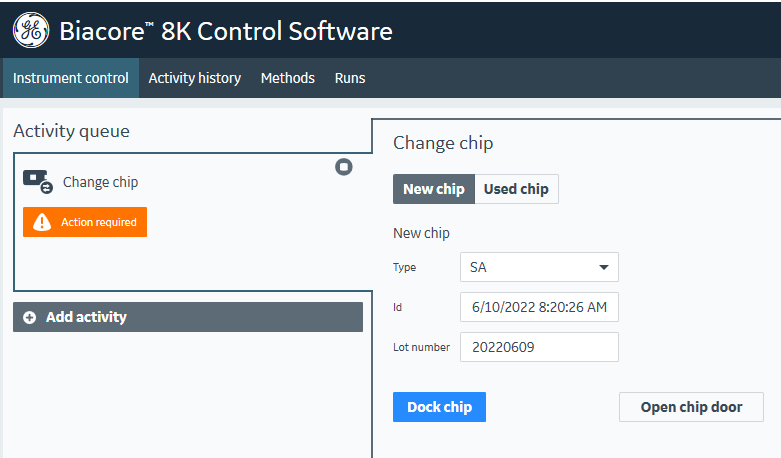
图18 芯片种类的选择
(5)手持芯片,有字的一面朝上。按照芯片上的箭头方向,将芯片轻轻推入卡槽,合上芯片舱的舱门。
(6)点击Dock Chip按钮,芯片置入后系统将自动转入待机(Standby)状态。
(7)选择instrument control,点击Change solutions,勾选Change buffer, water and reagent,点击Ready to start(图19)。缓冲溶液会以较高的流速冲洗整个内部流路系统,整个过程耗时6⁓7分钟。结束后,系统自动转入待机(Standby)状态。
注意:当系统更换缓冲溶液或者芯片后,必须运行Change solutions程序。Change solutions时缓冲溶液会冲洗整个流路系统,为下一步的实验做好准备。
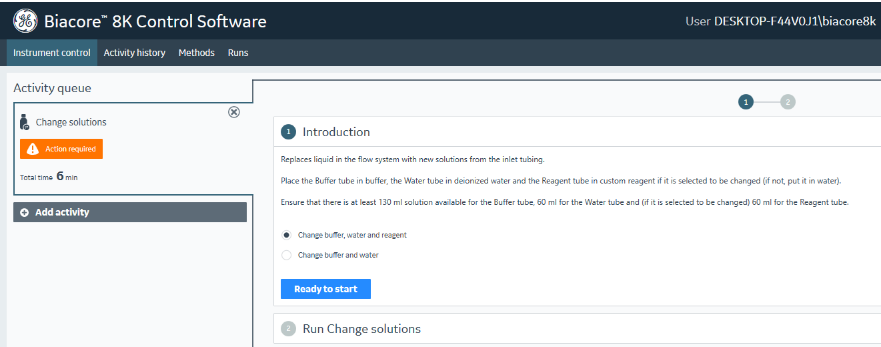
图19 Change solutions界面
- 配体的偶联
(1)打开Biacore 8K Control Software,选择Methods,点击Surface preparation,选择immobilization,点击Open(图20)。
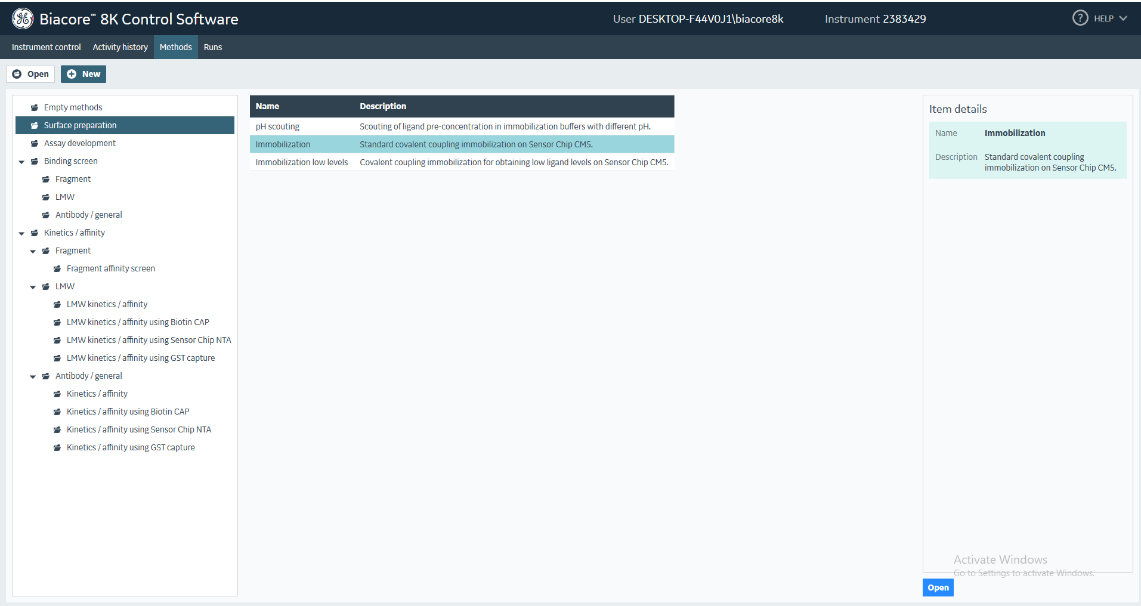
图20 SA芯片固定生物素化蛋白时偶联方法的建立
(2)在Method definition界面,Chip type选择SA,Running buffer输入HBS-P(根据实验体系的实际情况输入),温度一般默认25 °C(根据实验体系的实际情况输入),Add step选择SA-biotin capture,immobilize in选择Fc 2, activate/deactivate in 1, Ligand中contact time输入60 s,Flow rate 10 µL/min,在下方表格中输入固定蛋白的名字和选择需要进行固定的通道(图21)。在这里在表格中Flow cell 2 ligand name中输入TrpRS,选择同时固定8个通道。
注意:根据实际靶标蛋白的情况自行设置偶联实验,若一次达不到预定的偶联量,可以点击Custom mode按钮,删除NaCl/NaOH和Wash步骤,直接重复Ligand步骤。
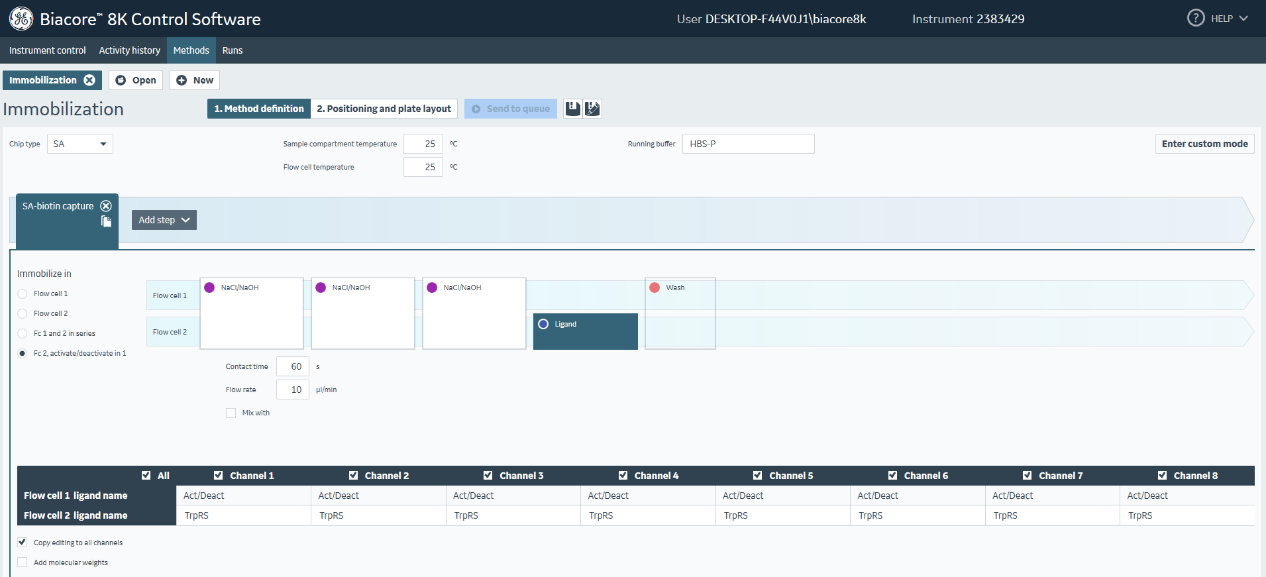
图21. SA芯片固定生物素化蛋白时系统方法中各参数的设置界面
(3)在Positioning and plate layout界面,根据仪器系统的要求完成样品在96孔板中的加样(图22)。20 ng/µL TrpRS放入96孔板的第一列,1 M NaCl, 50 mM NaOH放入96孔板的第二列,50% Isopropanol/50 mM NaOH/1M NaCl放入96孔板的第三列。
注意:若在Method definition界面中选择的蛋白固定通道少于8道,由于Biacore 8K中的8根进样针只能同上同下,因此需要在相应未固定蛋白的通道对应的96孔板中的位置中加入所需体积的缓冲溶液。
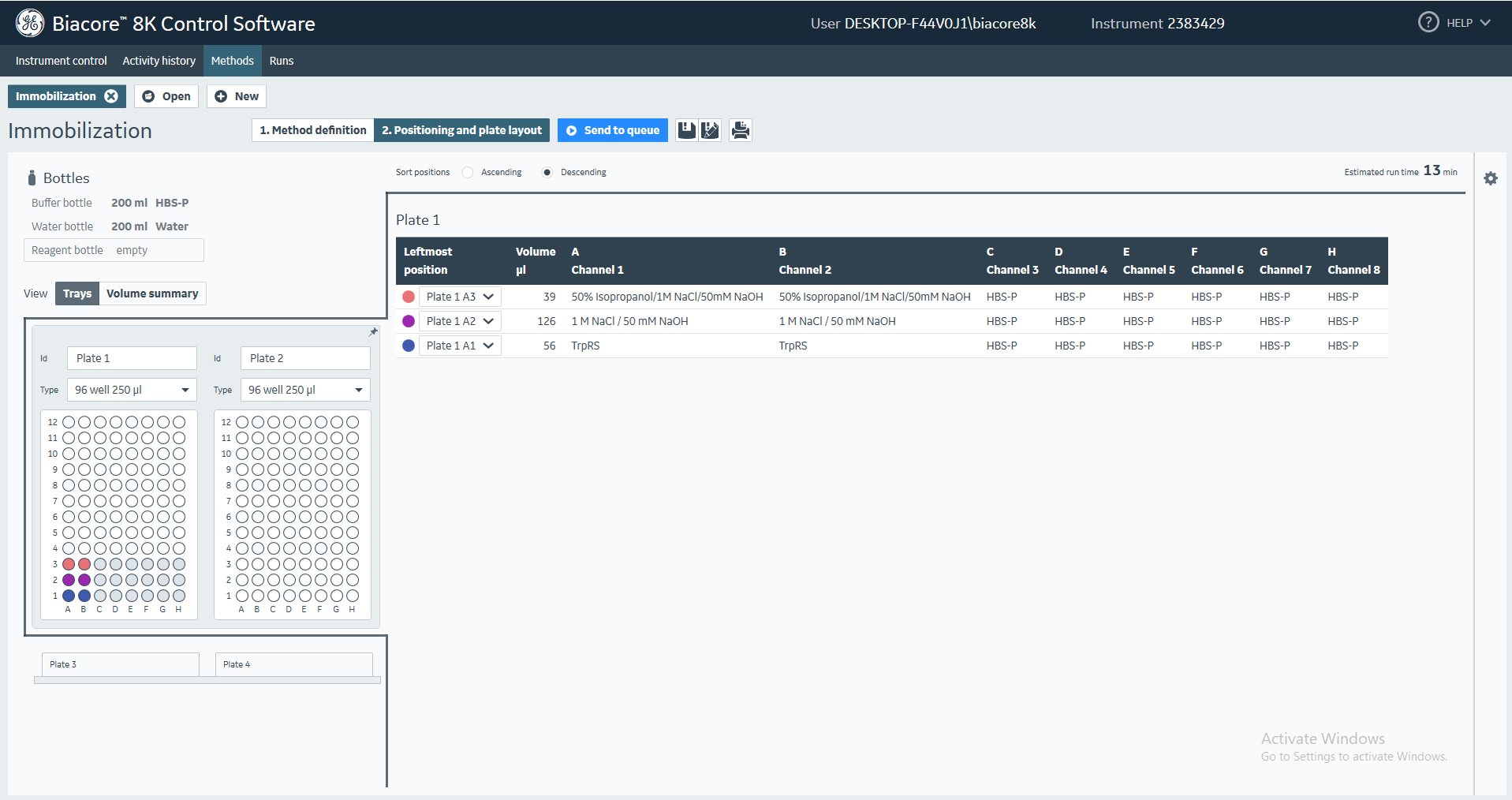
图22 生物素化蛋白偶联过程中对样品体积的要求以及放置位置的设置
(4)选择instrument control,点击下方的Hotel door is Open,将加好样品的96孔板放置于样品仓的对应位置中,关上舱门(图23)。

图23 样品板的放置
(5)点击Methods,Send to queue,开始His-avitag (biotin)-TrpRS的固定。
- 样品制备以及上机检测
(1)配制运行缓冲溶液和溶剂校正曲线。运行缓冲溶液和溶剂校正曲线的配制同实验步骤第二部分《2. 样品制备以及上机检测》中的内容。因有两种不同条件的缓冲溶液,因此需要配制两组不同的运行缓冲溶液以及缓冲溶液背景下的溶剂校正曲线。缓冲溶液体积根据设备的具体要求定。
(2)吲哚霉素浓度的配制。使用DMSO将10 mM吲哚霉素稀释至400 μM,然后,使用1.05× 的两种HBS-P缓冲溶液分别稀释400 μM小分子母液20倍,得到终浓度为20 μM在5% DMSO中的吲哚霉素溶液。以1.0× 含5% DMSO的两种HBS-P缓冲溶液分别作为相应的零浓度。
(3)多循环动力学/亲和力分析程序设。将其中一个已经配制好的1.0× 含5% DMSO的HBS-P缓冲溶液放在Biacore 8K系统右侧,换上黑色的单孔盖,将缓冲溶液进液管(注意软管上的蓝色标签)插入至缓冲溶液瓶底部,上述已放置好的水和再生试剂不动。选择instrument control,点击Change solutions,勾选Change buffer, water and reagent,点击Ready to start。
(4)点击Methods,选择New,LMW下拉菜单中的LMW kinetics/affnity,继续选择右栏中的LMW multi-cycle kinetic/affinity,点击Open(图24)。
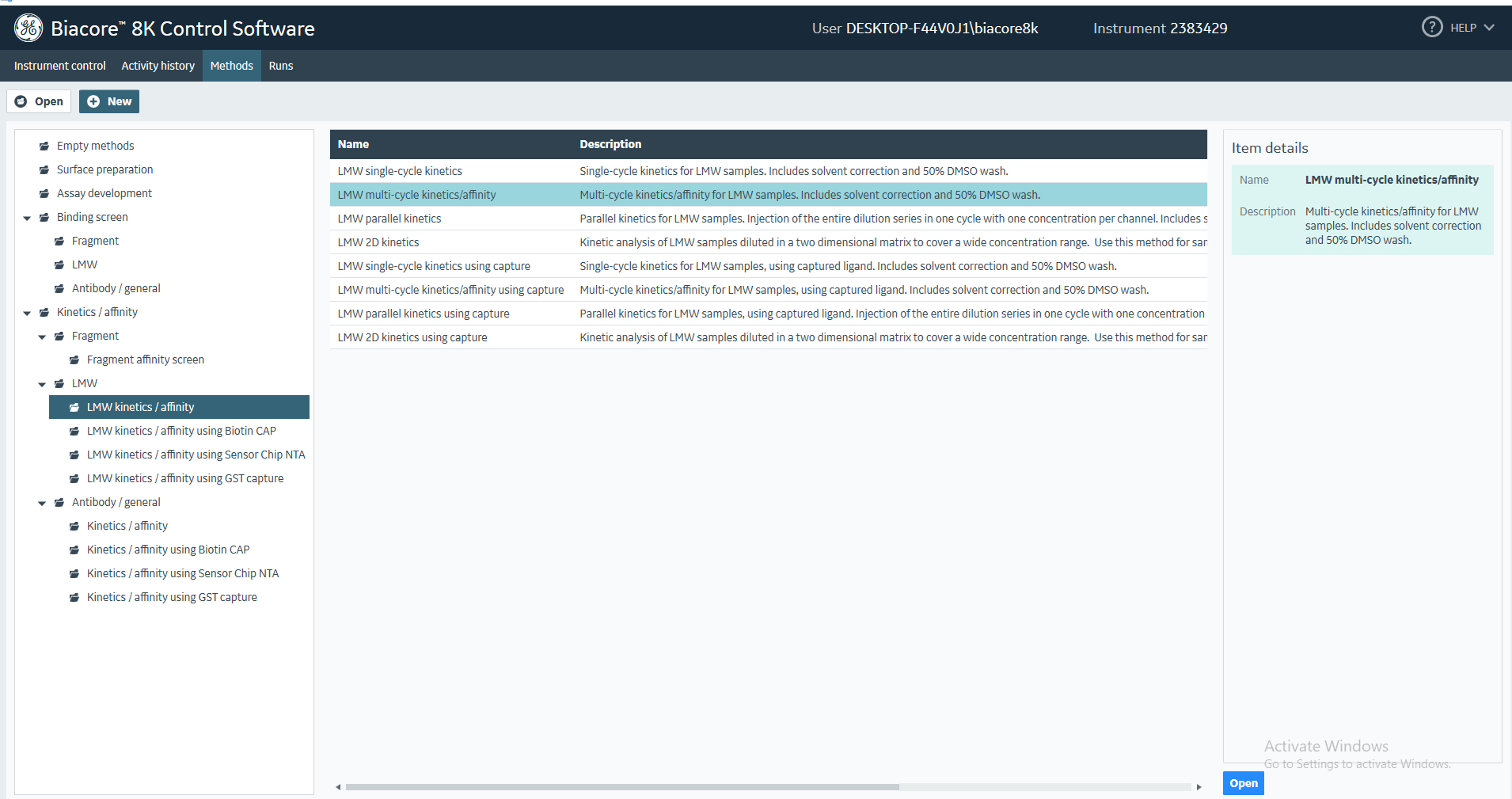
图24 多循环动力学/亲和力分析程序的建立
(5)在Method definition界面,点击Start up,选择Analyte 1, Solution输入HBS-P, MgCl2,Contact time输入60 s,Dissociation time输入120 s,Flow rate输入30 µL/min,Type下拉菜单选择High Performance,Flow path选择both flow cells,Wash 1默认50% DMSO溶液,Flow cell temperature默认25 °C(图25)。上述参数的输入都可以按照实验体系的实际情况进行输入和修改。
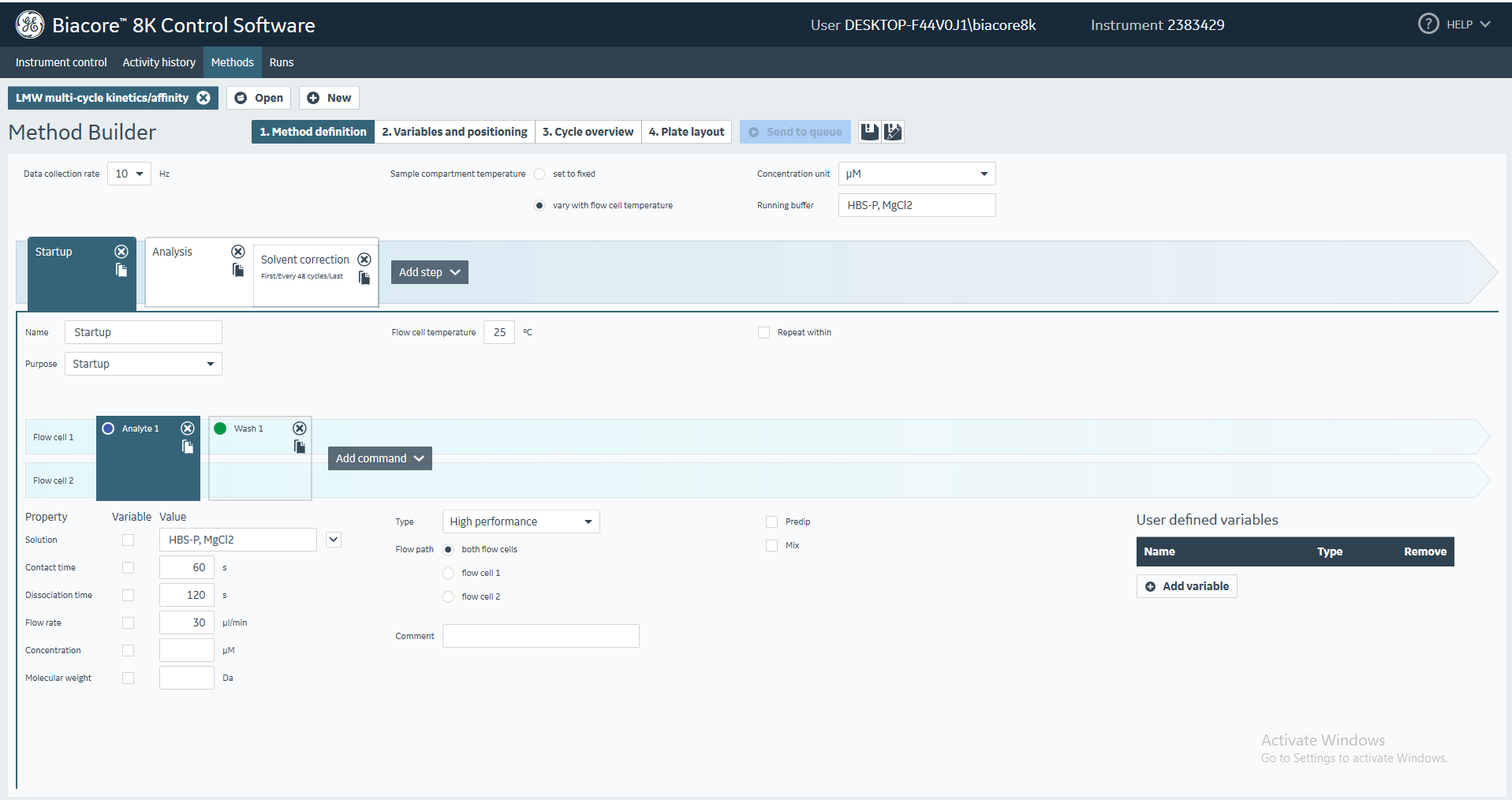
图25 多循环动力学/亲和力分析程序中Startup相关实验参数的设置
(6)点击Analysis选项,在Analysis界面,在Variable一栏勾选Solution和Concentration,Contact time输入60 s,Dissociation time输入120 s,Flow rate输入30 μL/min,Type下拉菜单选择High Performance,Flow path选择both flow cells,Wash 1默认50% DMSO,Flow cell temperature默认25 °C(图26)。
注意:一般Start up和Analysis中Analyte 1内设置的结合、解离时间和流速是一致的。为了消除物质迁移效应,Flow rate一般默认输入30 µl/min,若实验体系为亲和力很强的样本,则可以提高流速至50或者100 µl/min。若参数是变量,则可以在Variable一览的方框中进行勾选,变量参数可以在后续的Variable and positioning中进行填写。

图26 多循环动力学/亲和力分析程序中流动相相关实验参数的设置
(7)点击Solvent correction选项,Number of solutions per cycle选择4,勾选Repeat within Analysis every 100 cycles,勾选Run once first,Flow cell temperature默认25 °C(图27)。
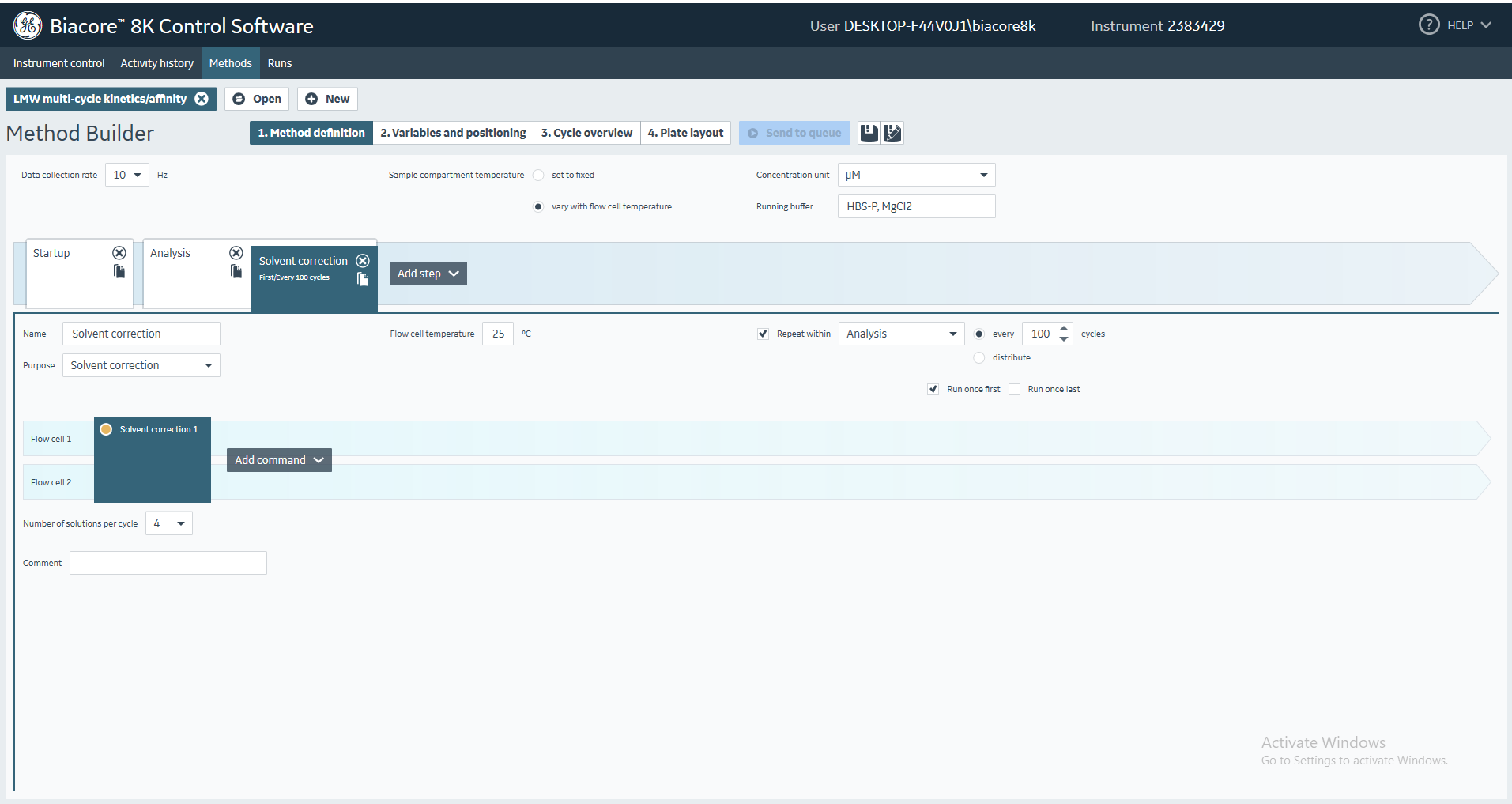
图27 多循环动力学/亲和力分析程序中溶剂校正相关实验参数的设置
(8)在Variable and positioning界面,勾选进行实验的通道,选择Startup,点击Add cylce,将startup增加为三个(图28)。
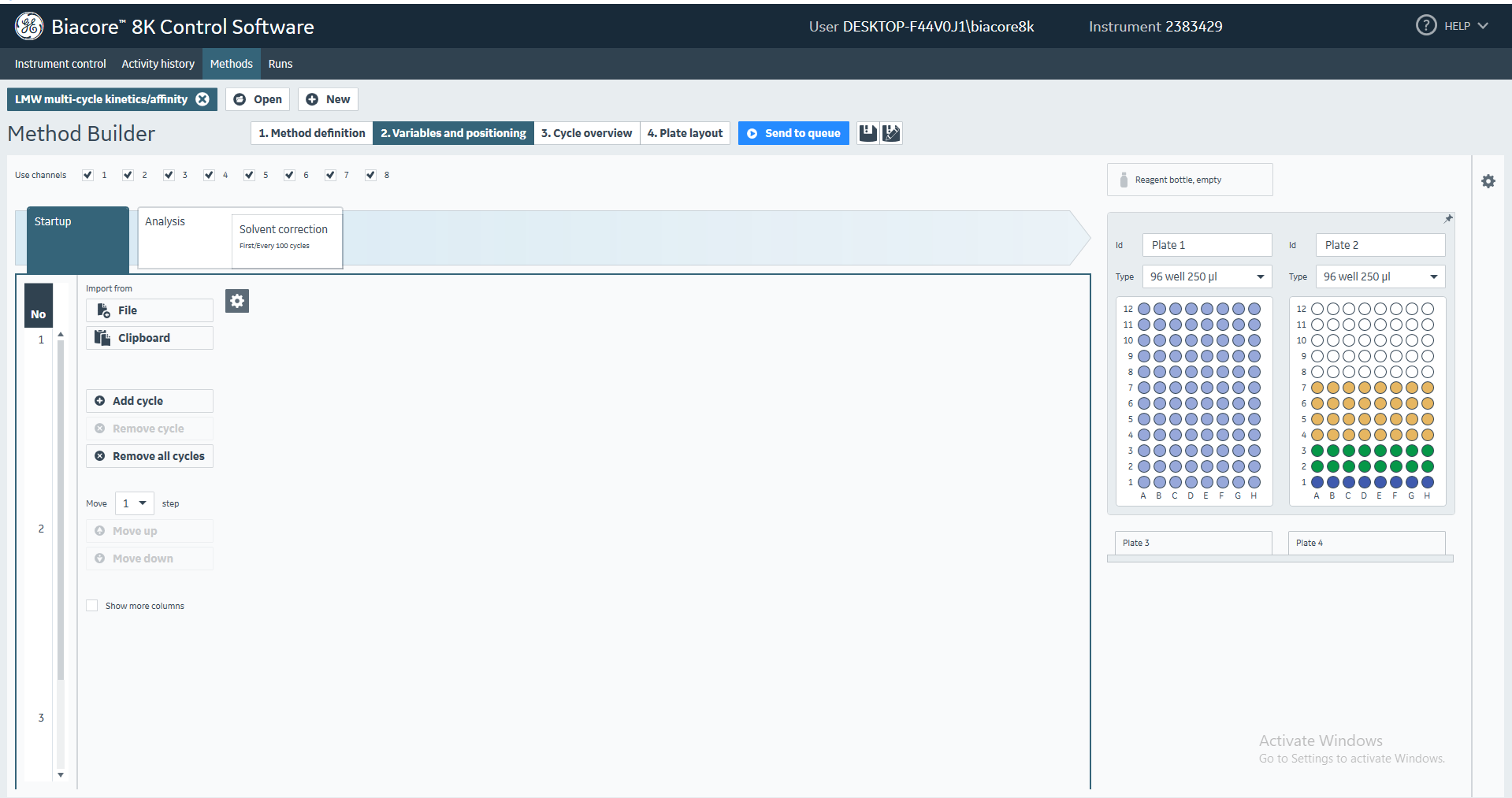
图28 多循环动力学/亲和力分析程序中Startup重复次数的设置
(9)在Variable and positioning界面,选择Analysis,Analyte 1 Solution输入吲哚霉素的名称,Concentration输入吲哚霉素的浓度(图29)。同时,可以通过拖拽对右侧默认的孔板放置位置以及孔板中样品的放置位置进行调整。
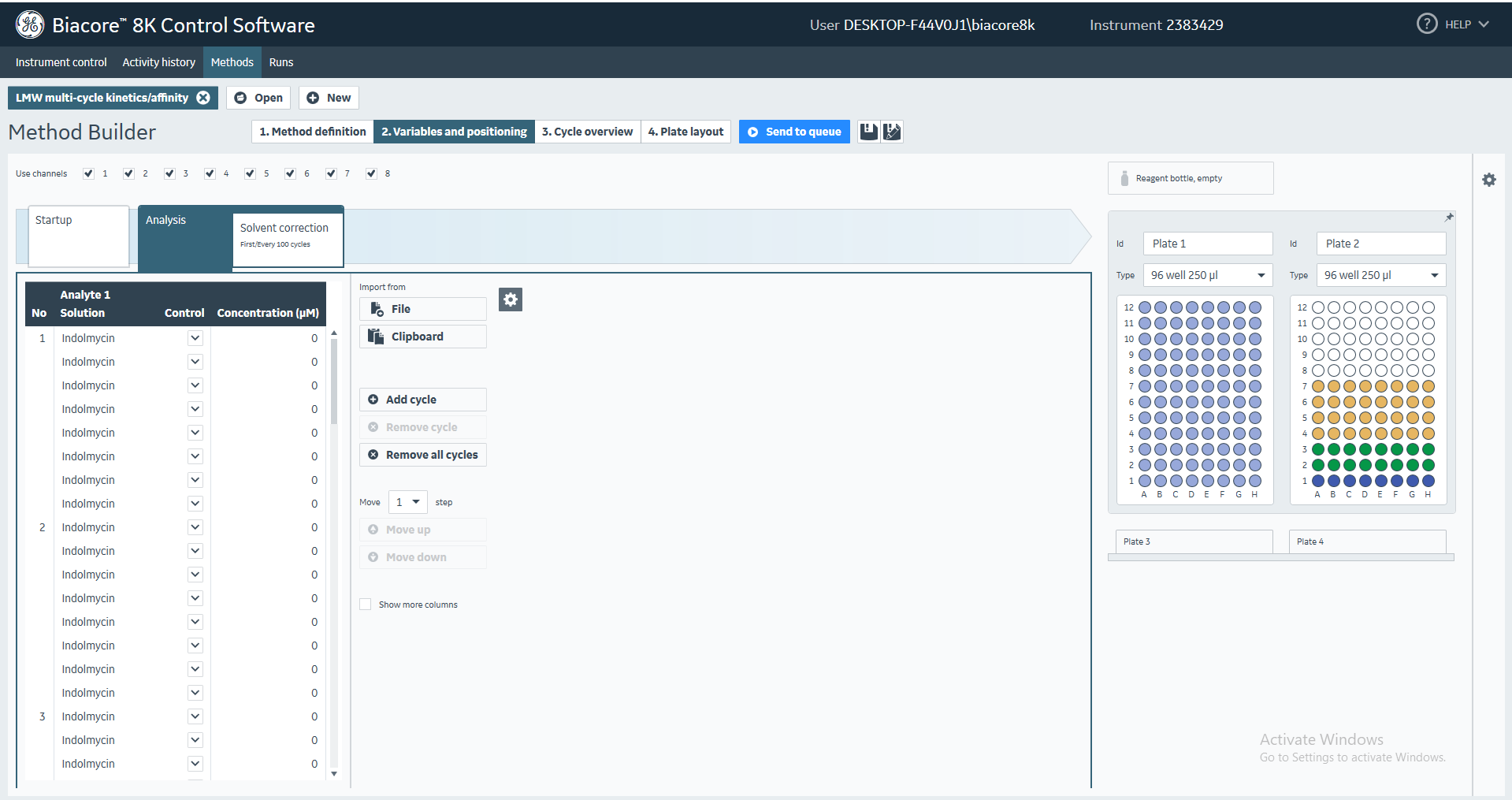
图29 多循环动力学/亲和力分析程序中流动相检测通道、浓度梯度和放置位置的设置
(10)在Cycle overview界面,可以看到整个实验的上样流程(图30)。
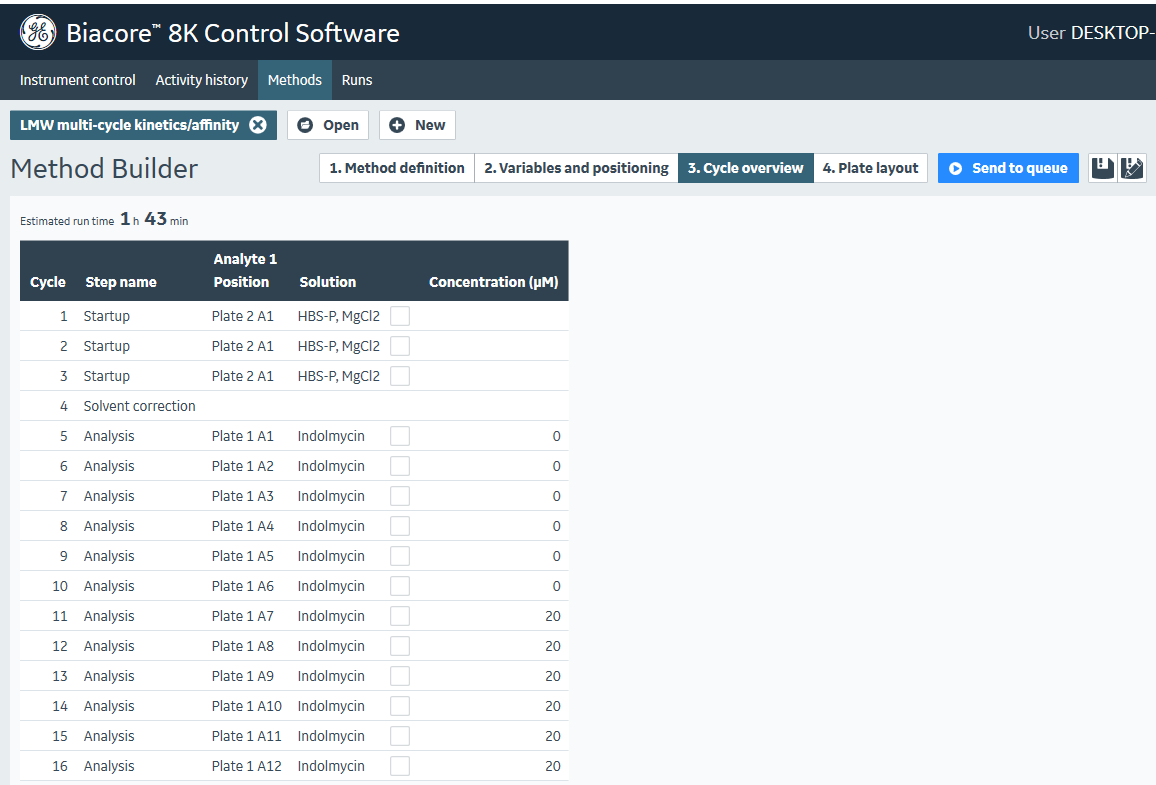
图30 实验进样流程
(11)在Plate layout界面,根据仪器系统的要求完成样品在96孔板中的加样(所加样品体积一般比系统要求至少多10 μL)(图31)。同样,若在Variable and positioning界面中选择的检测通道少于8道时,需要在未检测通道对应的96孔板中加入对应体积的缓冲溶液。正式实验中,为防止样品挥发,需要对加好样品的96孔板封膜。
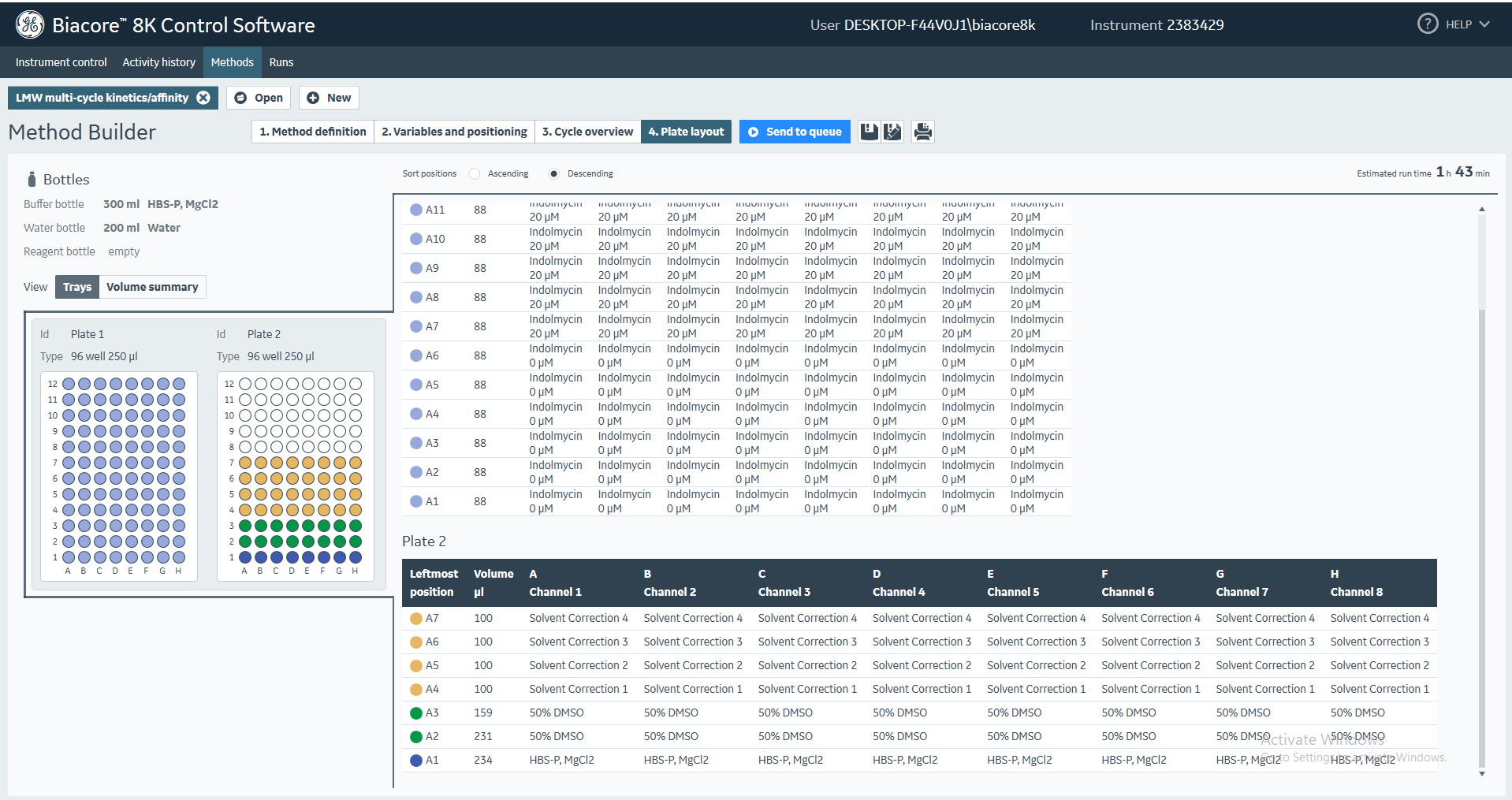
图31 多循环动力学/亲和力分析程序检测过程中对样品体积和放置位置的要求
(12)选择instrument control,点击下方的Hotel door is Open,将加好样品的96孔板放置于样品仓的对应位置中,关上舱门。点击Methods,Send to queue,开始正式的互作实验。
- 数据分析与数据解析
(1)打开数据分析软件Biacore Insight Evaluation Software,在Create new evaluation界面,选择select run,找到运行的程序,点击右下方的select evaluation method。
(2)在Select evaluation method界面,选择Kinetic/affnity选项中的LMW,点击LMW multi-cycle affinity-Evaluation method,点击Open(图32)。
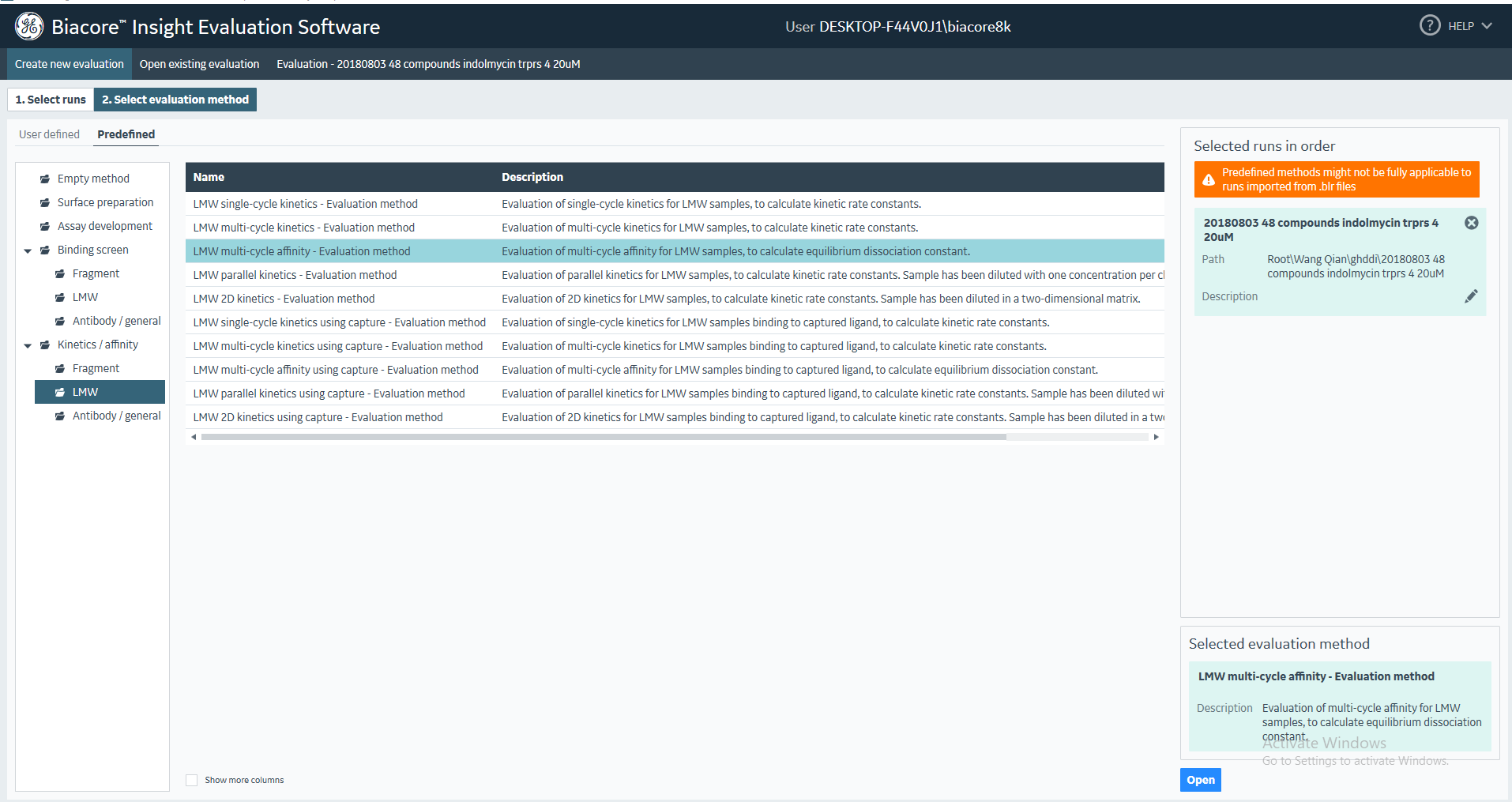
图32 多循环亲和力分析程序的建立
(3)首先弹出Solvent Correction界面进行溶剂校正分析(图33)。若结果正常,点击Apply and close。溶剂校正曲线一般要求落在-500到+1,000 RU之间,Chi2小于2。如果超出此范围较多,一般是由于DMSO浓度配制不准确造成。
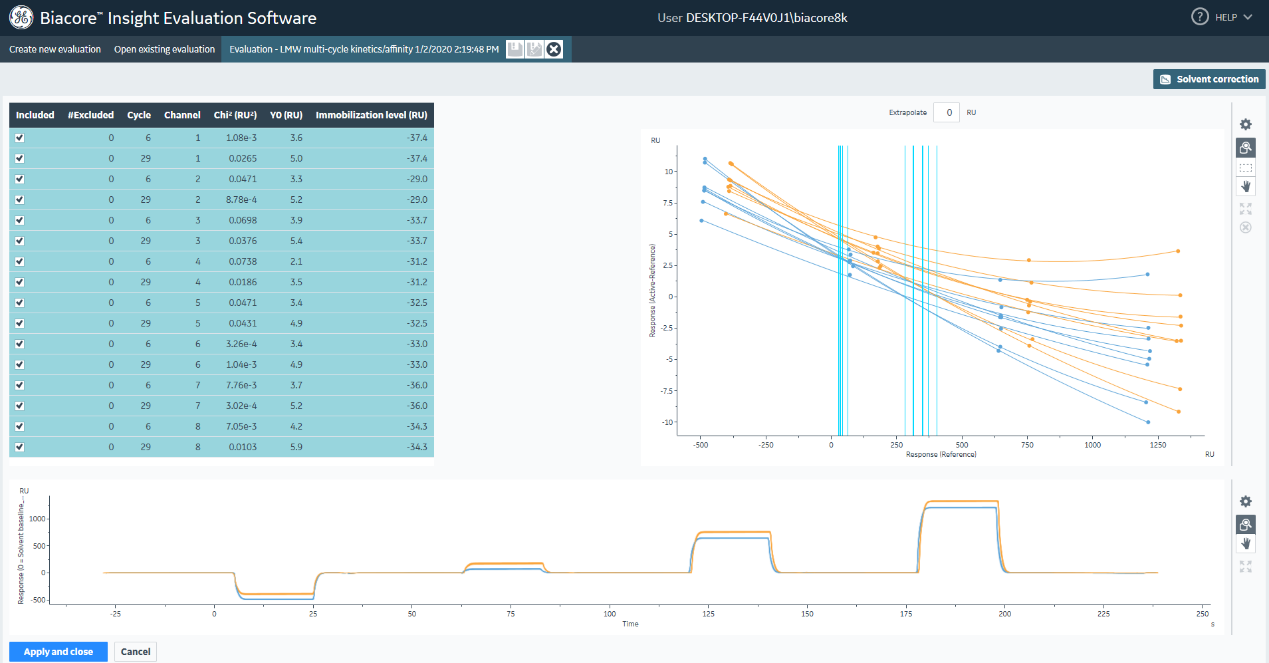
图33 溶剂校正曲线
(4)在Home界面,点击plot,即可得此条件下吲哚霉素的响应值,返回Home界面,点击presentation,勾选需要导出的结果内容,点击Export to presentation(图34)。
注意:因有两种不同种类的缓冲溶液条件,因此需要再更换缓冲溶液后,重复实验内容。

图34. 数据的导出
实验注意要点
- 成功经验
(1)标签和固定方式的优化:本次研究通过多次实验优化了TrpRS的标签和芯片固定方式,使SPR体系在高通量筛选中的适应性和灵敏度显著提高,Z因子数值稳定在0.9以上。这表明多维度优化策略能够提升实验的重现性和数据质量。
(2)缓冲溶液条件的改进:针对TrpRS蛋白的特殊性,逐步调整缓冲液的成分,提升了实验的稳定性与信号强度。 - 遇到的问题及解决方案
(1)初期固定方式效果不佳:初期实验选择的固定方式未能达到预期的稳定性、结合强度和重现性,改用多种固定方式实验对比,最终找到最佳固定条件。
在NTA捕获固定过程中,需要考虑捕获后基线的稳定性,若后续结合过程中基线发生漂移,会影响互作结合结果。改善的实验方法包括:重新构建目的蛋白的质粒,增加组氨酸标签的长度;更改标签类型;更改固定方式;降低捕获量等。
(2)缓冲液适配问题:在某些缓冲液条件下信号弱或噪声高,通过逐步调整缓冲盐类型、离子浓度等参数并更换试剂,最终得到适合TrpRS的特定缓冲液组合,提升了检测的灵敏度和数据质量。
(3)蛋白质量的问题:实验过程中,有很多目的蛋白购买于公司,但时常会出现固定不上或者固定上没有结合活性的现象,因此这时建议使用差示扫描量热(DSF)或者圆二色谱(CD)技术等对购买蛋白的质量进行表征分析。
(4)建议:在类似实验中,若结果不稳定,应尝试对蛋白质量、标签、固定方式及缓冲溶液进行逐一排查和调整,以实现参数的最佳组合。 - 常见错误或失败经验
(1)结合条件错误:曾尝试在标准缓冲液条件下进行实验,但未能获得阳性结果。调整缓冲液类型和成分后改善了信号强度和亲和力,表明反应条件对TrpRS的结合效率影响显著。
(2)试剂纯度及批次问题:发现某些批次的缓冲试剂纯度不足,影响信号的稳定性,因此严格筛选高纯度的试剂是成功的关键。
(3)固定方式单一:直接选择一种固定方式可能导致结合效率偏低或检测不灵敏,多种固定方式的对比有助于找到最佳的结合效果。
(4)溶剂校正的配置:溶剂校正的配置是日常实验中比较容易出错的点,配置过程需要充分涡旋混匀。若溶剂校正和含DMSO的缓冲溶液不能正确对应,则可以以0.1% DMSO对应的SPR响应值为120 RU进行缓冲溶液中DMSO量的调整。 - 补救措施
(1)缓冲溶液优化:若实验信号低或背景噪声过高,可适当调整缓冲液的pH值、离子强度,或更换试剂以减少非特异性结合。
(2)重新固定与清洗:若固定过程导致结合不理想,可在清洗芯片后重新固定目标蛋白(限非共价的固定方式),调整固定方式和试剂浓度,尝试得到更好的结合效果。
(3)样品浓度调整:若样品或阳性化合物浓度不足导致信号不明显,可浓缩样品或增大阳性化合物的初始浓度,确保信号强度。
结果与数据分析
一、NTA芯片捕获His-TrpRS
本次实验偶联量约为1000 RU,但由于固定TrpRS后的基线不断下降,无法正常进行后续的实验检测[1](图35),因此改用Ni2+螯合联合氨基偶联的方法固定TrpRS。TrpRS固定后基线不稳定可能是由于TrpRS在氨基末端只有6个组氨酸引起的。
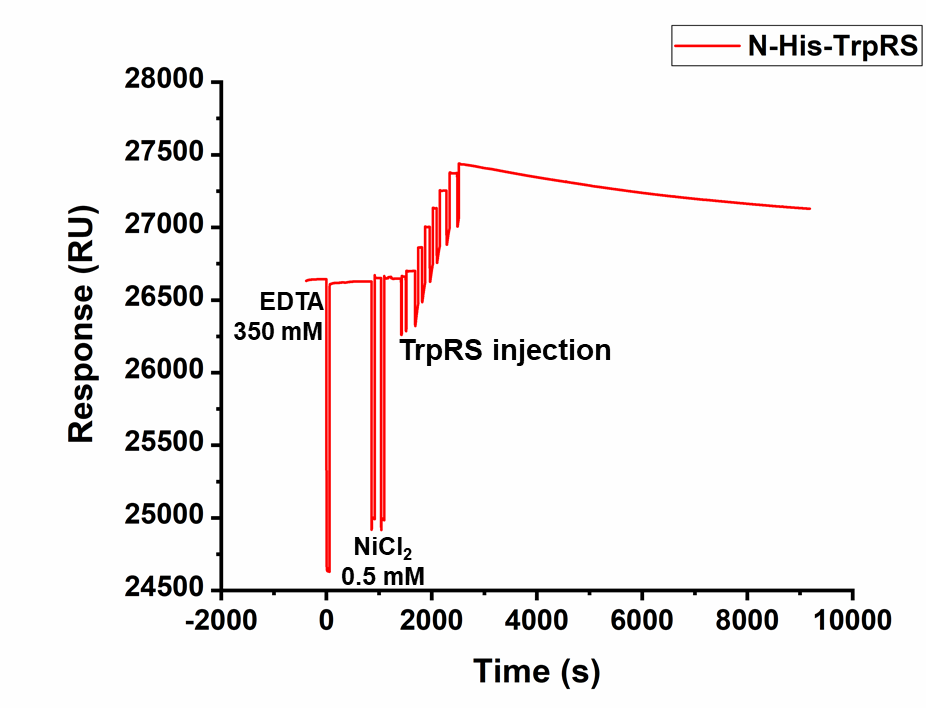
图35 NTA芯片固定TrpRS的实验结果图
二、NTA芯片联合氨基偶联完成TrpRS的固定,表征TrpRS与吲哚霉素的结合
本次实验偶联量约为1000 RU,固定的TrpRS基线稳定,可以进行后续实验(图36)。经拟合,在此条件下,吲哚霉素与TrpRS的亲和力KD为29 ± 19 µM(图37)。但吲哚霉素结合信号较低且实验结果重复性略差。
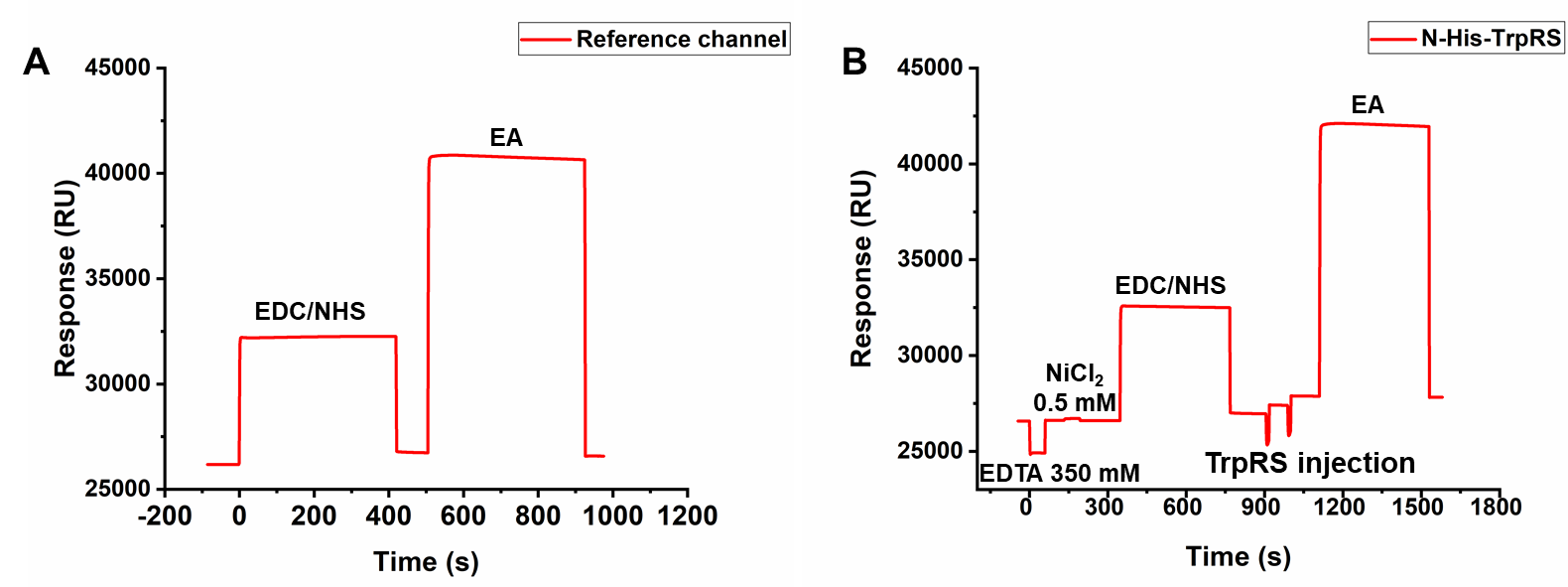
图36 NTA芯片联合氨基偶联固定TrpRS的实验结果图
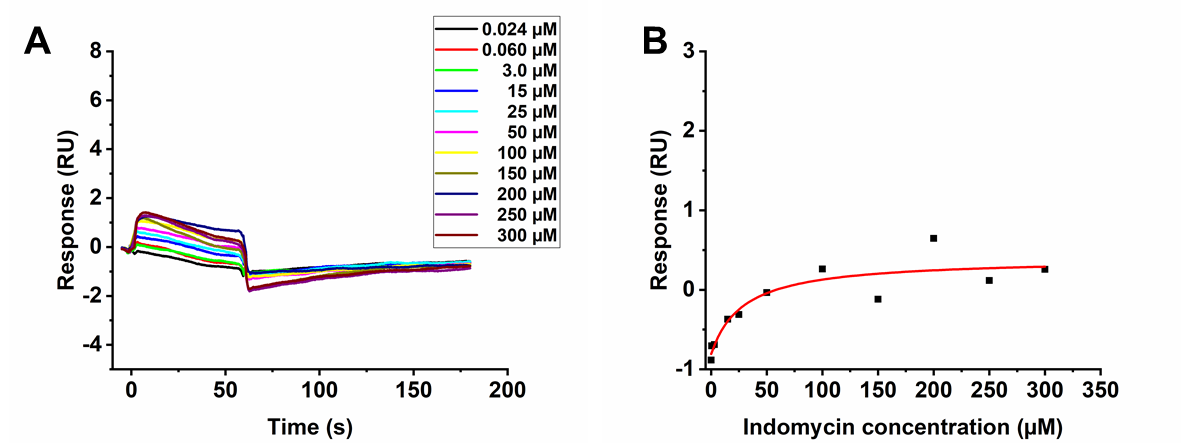
图37. 吲哚霉素在PBS-P实验条件中,对TrpRS的亲和力结果图。A. 吲哚霉素与TrpRS的结合解离传感图;B. 吲哚霉素与TrpRS的亲和力模型拟合结果
三、SA芯片固定His-avitag (biotin)-TrpRS,表征TrpRS与吲哚霉素的结合
本次实验偶联量约为1,010 RU(图38)。经拟合,在此条件下,吲哚霉素与TrpRS的亲和力KD为16.7 ± 3.6 μM(图39)。
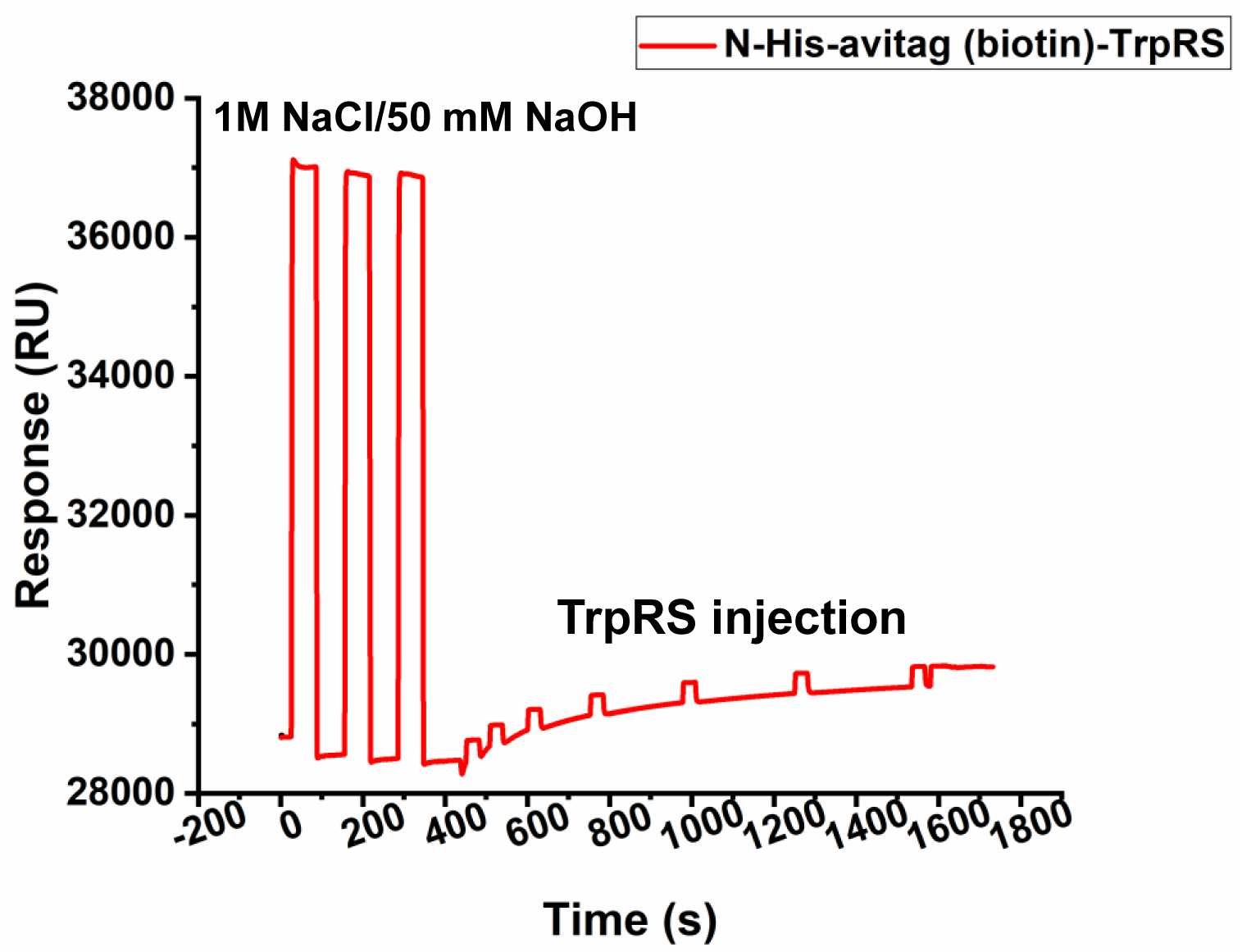
图38 His-avitag (biotin)-TrpRS的偶联结果图

图39 吲哚霉素在PBS-P实验条件中,对TrpRS的亲和力结果图。A. 吲哚霉素与TrpRS的结合解离传感图;B. 吲哚霉素与TrpRS的亲和力模型拟合结果
四、SA芯片固定His-avitag (biotin)-TrpRS,表征TrpRS与吲哚霉素在不同PBS-P缓冲溶液条件中的结合,优化结合体系
经拟合,吲哚霉素与TrpRS在PBS-P缓冲溶液(含1.0 mM MgCl2),PBS-P缓冲溶液(含1.0 mM ATP),PBS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM AMP)以及PBS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP)中的亲和力KD数值分别为16.7 ± 3.4,16.2 ± 2.3,18.8 ± 2.6 µM以及1.5 ± 0.2 μM(图40)。

图40 吲哚霉素在PBS-P缓冲溶液(含1.0 mM MgCl2)(A-B),PBS-P缓冲溶液(含1.0 mM ATP)(C-D),PBS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM AMP)(E-F)以及PBS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP)(G-H)实验条件中,对TrpRS的亲和力结果图
五、SA芯片固定His-avitag (biotin)-TrpRS,表征TrpRS与吲哚霉素在PIPES-P, TRIS-P以及HBS-P缓冲溶液中的结合,继续优化结合体系
经拟合,吲哚霉素与TrpRS在HBS-P缓冲溶液(含1.0 mM MgCl2),HBS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP),PIPES-P缓冲溶液(含1.0 mM MgCl2),PIPES-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP),TRIS-P缓冲溶液(含1.0 mM MgCl2),TRIS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP)中的亲和力KD值分别为13 ± 2(A⁓B),0.6 ± 0.1(C⁓D), 14.3 ± 0.6(E⁓F)、3.5 ± 0.2(G⁓H), 14.7 ± 3.0(I⁓J)和4.7 ± 0.5 µM(K⁓L)(图41)。
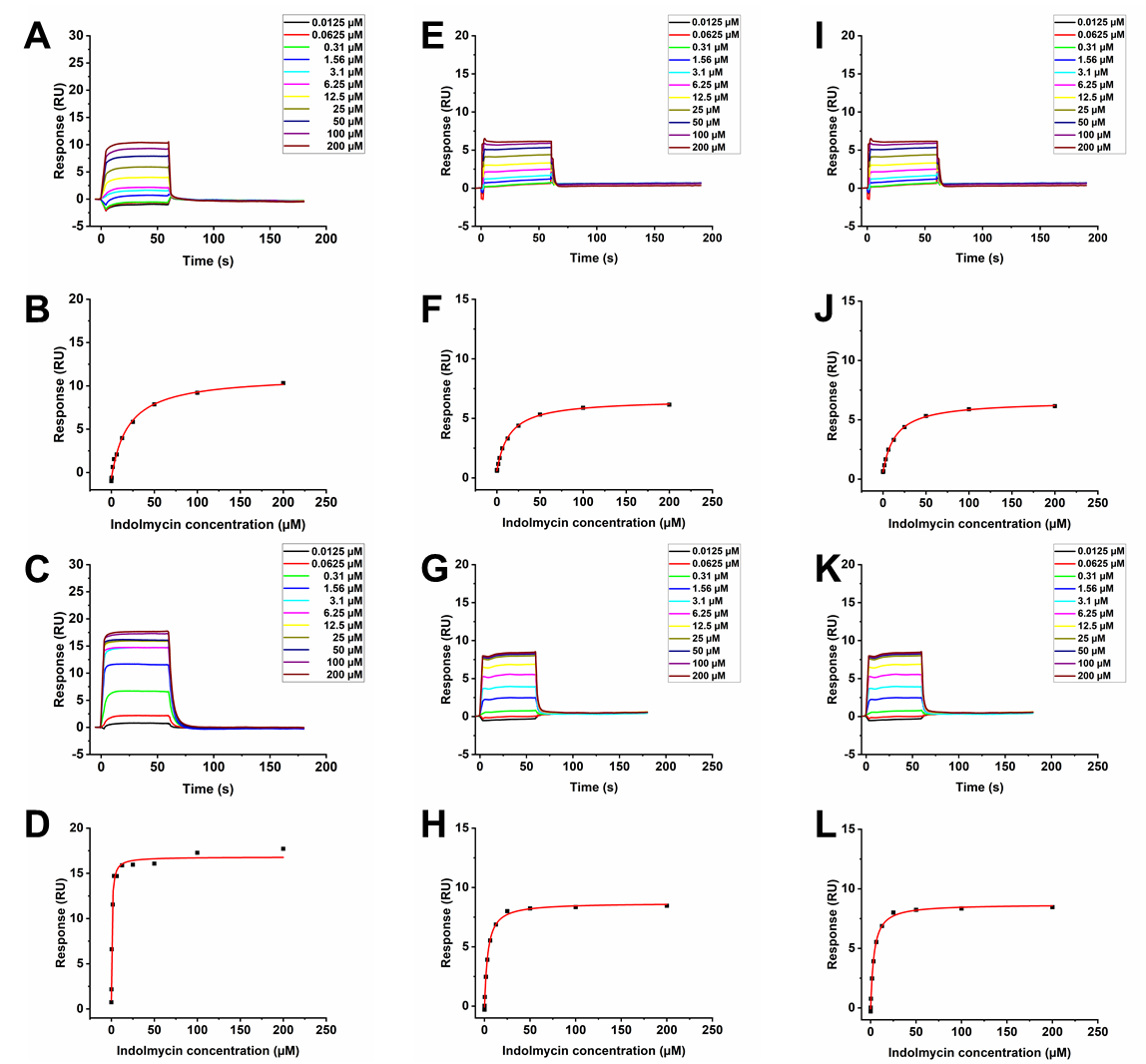
图41. 吲哚霉素在在HBS-P缓冲溶液(含1.0 mM MgCl2)。A⁓B. HBS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP;)C⁓D. PIPES-P缓冲溶液(含1.0 mM MgCl2);E⁓F. PIPES-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP);G⁓H. TRIS-P缓冲溶液(含1.0 mM MgCl2);I⁓J. TRIS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP);K⁓L. 实验条件中,对TrpRS的亲和力结果图
六、SA芯片固定His-avitag (biotin)-TrpRS,构建TrpRS与吲哚霉素在HBS-P缓冲溶液条件下的高通量筛选体系
经计算,HBS-P缓冲溶液(含1.0 mM MgCl2) 缓冲溶液条件下的Z因子为0.91(A),而 HBS-P缓冲溶液(含1.0 mM MgCl2和1.0 mM ATP)缓冲溶液条件下的Z因子为0.93(B)(图42)。
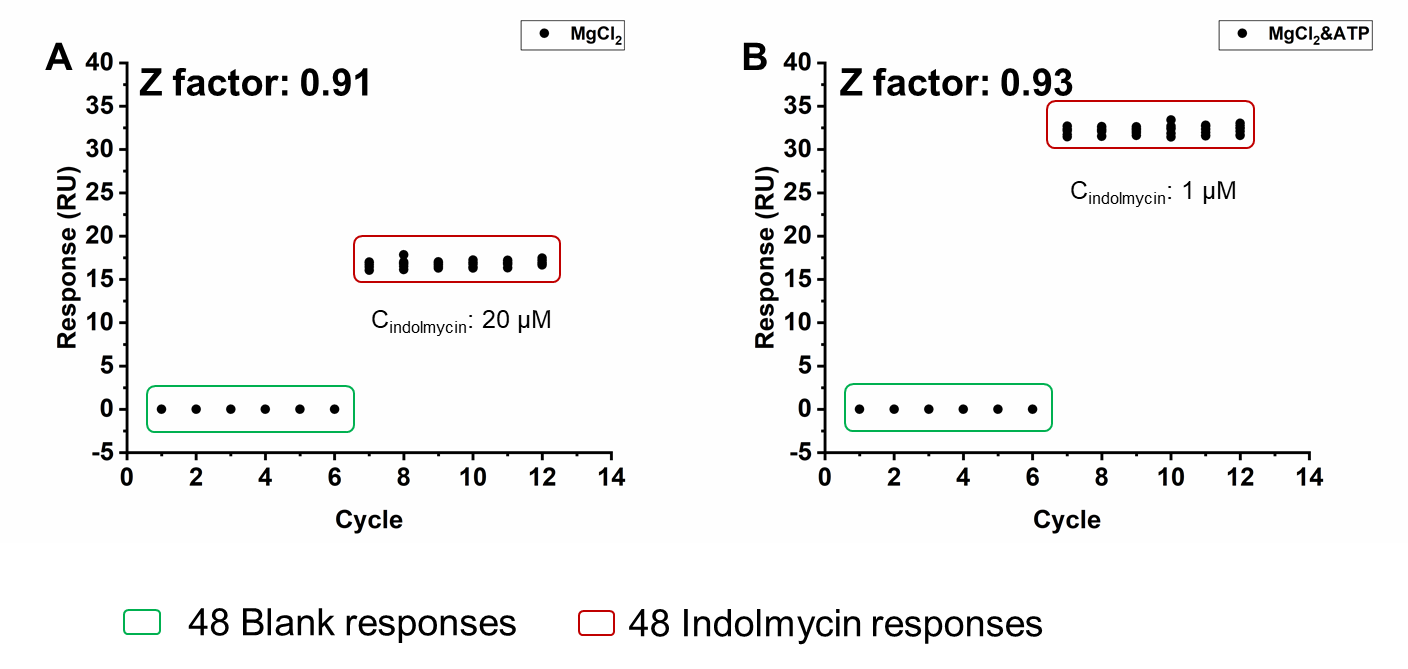
图42 TrpRS SPR高通量筛选系统的可靠性测试
溶液配方
缓冲液最终体积需根据实验要求确定
- 1.05× PBS-P缓冲溶液
量取52.5 mL 10× PBS-P用去离子水(已完成0.22 µm膜过滤处理)稀释到500 mL,混匀,配成1.05× PBS-P。 - 1.0× 含5% DMSO 缓冲溶液
量取152 mL 的1.05× 缓冲溶液,加入8 mL DMSO(已完成0.22 μm膜过滤处理),混匀,配置1.0× 含5% DMSO的缓冲溶液。 - 1.05× PBS-P缓冲溶液(含1.05 mM MgCl2)
量取21 mL 10× PBS-P缓冲溶液以及210 μL 1M MgCl2水溶液,使用去离子水(已完成0.22 µm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。 - 1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)
量取21 mL 10× PBS-P缓冲溶液,210 μL 1 M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。 - 1.05× PBS-P缓冲溶液(含1.05 mM ATP)
量取21 mL 10× PBS-P缓冲溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液(含1.05 mM ATP),混匀后放入缓冲溶液瓶。 - 1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM AMP)
量取21 mL 10× PBS-P缓冲溶液,210 μL 1 M MgCl2水溶液以及420 μL 500 mM AMP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM AMP),混匀后放入缓冲溶液瓶。 - 1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2)
量取2.1 mL 1 M PIPES水溶液,10.5 mL 3 M NaCl水溶液,1.05 mL P20以及210 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。 - 1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)
量取2.1 mL 1 M PIPES水溶液,10.5 mL 3 M NaCl水溶液,1.05 mL P20,210 μL 1 M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× PIPES-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。 - 1.05× HBS-P缓冲溶液(含1.05 mM MgCl2)
量取21 mL 10× HBS-P缓冲溶液以及210 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× HBS-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶 - 1.05× HBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)
量取21 mL 10× HBS-P缓冲溶液,210 μL 1 M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× HBS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。 - 1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2)
量取2.1 mL 1 M TRIS水溶液,10.5 mL 3 M NaCl水溶液,1.05 mL P20以及210 μL 1 M MgCl2水溶液,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2),混匀后放入缓冲溶液瓶。 - 1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP)
量取2.1 mL 1 M TRIS水溶液,10.5 mL 3M NaCl水溶液,1.05 mL P20,210 μL 1 M MgCl2水溶液以及420 μL 500 mM ATP,使用去离子水(已完成0.22 μm膜过滤处理)稀释至200 mL,配制1.05× TRIS-P缓冲溶液(含1.05 mM MgCl2和1.05 mM ATP),混匀后放入缓冲溶液瓶。
致谢
感谢 Cytiva Biacore大中华区产品经理吴嘉伟提供的技术支持。本项目得到了国家自然科学基金(资助号:22107004,21772005)和北京自然科学基金(资助号:7202088)的支持。
参考文献
- Wang, Q., Zhu, G. and Liu, Z. (2021). Establishment of inhibitor screening and validation system for tryptophanyl tRNA synthetase using surface plasmon resonance. Anal Biochem. 623: 114183. https://doi.org/10.1016/j.ab.2021.114183
- Zhang, J. H., Chung, T. D. and Oldenburg, K. R. (1999). A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. SLAS Discovery. 4(2): 67–73. https://doi.org/10.1177/108705719900400206
引用格式:王倩, 朱贵旺, 刘振明. (2024). 基于表面等离子共振技术构建色氨酰tRNA合成酶的抑制剂筛选和验证体系. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011017. DOI:
10.21769/BioProtoc.1011017.
 How to cite:
How to cite: Wang, Q., Zhu, G. W. and Liu, Z. M. (2024). Establishment of Inhibitor Screening and Validation System for Tryptophanyl tRNA Synthetase Using Surface Plasmon Resonance. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011017. DOI:
10.21769/BioProtoc.1011017.
