引言
抗体药物的开发在针对已知靶点的药物开发和精准医疗中发挥着核心作用,而靶向特定表位的抗体是其设计的关键。表位归类实验通过分析抗体间的表位竞争关系,能够筛选出功能性抗体,优化联合用药策略,并支持专利保护[1,2]。这些特性使表位归类成为抗体药物研发不可或缺的一环。
传统的 ELISA 方法虽然在一定程度上满足了早期的需求,但由于操作复杂且难以提供实时动力学信息,其局限性日益显现。近年来,基于 SPR 和 BLI 的自动化高通量技术平台显著提升了实验效率和结果质量[3-5]。Carterra LSA、Sartorius Octet系列 和 Biacore 8K 是当前三种代表性平台,分别在中高通量筛选和精确动力学分析领域表现出色。本文将通过对这三种平台的对比和优化建议的讨论,并利用Carterra LSA 对96个抗体对的表位验证结果及分析作为例子,为抗体开发者提供技术参考。
材料与试剂
- 传感芯片
HC200M(Carterra LSA):适用于高结合容量实验,特别是需要高浓度偶联或捕获的情况。 - 偶联试剂
EDC(1-乙基-3-(3-二甲氨基丙基)碳二亚胺)和 NHS(N-羟基琥珀酰亚胺)用于偶联反应。 推荐品牌:Sigma-Aldrich(EDC:catalog number: E7750,NHS:catalog number: 130672)
乙醇胺(1 M,pH 8.5)用于封闭未反应的活性酯,防止非特异性结合。 推荐品牌:Thermo Fisher Scientific(catalog number: 28322) - 缓冲液与溶液
HBS-EP缓冲液:用于实验过程中维持芯片的环境稳定。
再生缓冲液(甘氨酸-HCl,pH 2.0–2.5):用于实验后的清洗与再生。
Tween-20:加入到缓冲液中以减少非特异性吸附。推荐品牌:Sigma-Aldrich(catalog number: P1379) - 样品与标准
目标抗体或抗原:浓度一般为1–10 µg/mL,根据偶联结果调整。确保纯度和稳定性。
竞争抗体:选择与目标抗体具有已知表位信息的抗体,用于进行竞争实验。
仪器设备
- Carterra LSA 系统:提供高通量、高分辨率的SPR分析。
- Carterra Navigator 软件:用于数据采集和分析,支持实验结果的实时监控和后期数据分析。
技术平台对比
一、Carterra LSA
- 平台技术与原理
Carterra LSA 基于 SPR 技术,通过实时监测光反射角变化来记录分子结合或解离引起的质量变化[6]。该平台的核心优势在于其 96 通道的微流控设计,支持在单次实验中完成多达数百个抗体配对的表位归类实验。通过生成竞争矩阵和热图,Carterra LSA 为表位分组提供了高效直观的分析方法。 - 表位实验应用
Carterra LSA 在抗体筛选和表位分析中的成功案例众多。例如,在针对病毒表面糖蛋白的研究中,有研究团队利用该平台在数周内完成了上百对抗体的表位归类,筛选出3对非竞争抗体,最终用于优化联合用药策略[7]。
在表位作图(epitope mapping)中,Analyte抗体与Competitor抗体的关系是通过竞争性结合揭示两者识别表位的空间位置关系。若某Competitor能阻断多个Analyte抗体结合,提示其靶向关键功能性表位(如受体结合域)。(Analyte抗体:待检测其抗原结合能力的抗体;Competitor抗体:用于竞争性阻断Analyte抗体结合的配对抗体。) - 实验流程
- 样品准备:目标抗体通过EDC/NHS偶联固定于芯片表面,偶联响应值需控制在500~5,000 RU之间;分析抗原稀释至100~200 nM(根据实际测试情况调整)。
- 实验操作:依次注射Analyte和Competitor抗体,结合时间为300秒,解离时间为100秒(根据实际测试情况调整)。
- 数据分析:利用软件生成热图和动力学数据报告,分析抗体间竞争关系,细分完全竞争、部分竞争和无竞争抗体组。
- 特点与优势
- 高通量能力:适合处理中等规模抗体筛选任务。
- 数据精准:动力学数据和竞争矩阵相结合,提供多维度分析。
- 实验效率高:热图可视化显著加快结果解读。
二、Sartorius Octet RED384 - 平台技术与原理
Octet RED384基于BLI技术,通过光干涉信号实时记录分子结合和解离过程[8]。其最大特色是支持384通道同时运行,能够满足超高通量的抗体筛选需求,是抗体开发早期筛选的优选工具。 - 表位实验应用
Octet RED384在免疫检查点抗体的开发中表现突出。利用该平台可在短时间内筛选抗体并生成表位矩阵,得到具有独特结合特性的候选抗体用于后续的功能性验证。 - 实验流程
- 样品准备:目标抗原通过His标签捕获,或通过化学偶联,响应值推荐范围为1.0~1.5 nm。
- 结合与竞争实验:分别注射Analyte和Competitor抗体,结合和解离时间均为200秒,可根据测试情况进行调整。
- 数据分析:基于光程偏移生成竞争矩阵,初步评估抗体的相互竞争特性并据此进行表位归类。
- 特点与优势
- 高通量:适合大规模抗体筛选任务,且对样品质量要求相对较低。
- 操作简便:抗原捕获过程快速,成本较低。
- 灵活性高:光纤传感器可重复使用,降低试剂消耗。
三、Biacore 8K - 平台技术与原理
Biacore 8K也是基于SPR技术的平台,以其动力学测定的高精度和灵敏度见长[9]。与Carterra LSA不同,Biacore 8K更倾向于提供深度动力学分析,适合研究复杂分子交互和抗体开发后期的表位精细分组。 - 表位实验应用
Biacore 8K在抗体开发中发挥了重要作用。通过表位竞争实验,研究团队可以筛选出针对特定靶点的高特异性抗体组合,为后续药物设计提供了精准依据。 - 实验流程
- 靶分子固定:通过氨基偶联将抗原固定到芯片表面,并优化密度以确保表位暴露。
- 实验操作:通过逐步注射抗体进行结合动力学和竞争关系测定。
- 数据分析:使用Biacore Insight软件进行数据分组和动力学验证。
- 特点与优势
- 高灵敏度:适合低浓度和低亲和力样本分析。
- 深度分析能力:支持精准动力学测定和表位分组的需求。
- 数据精确:分辨率高,适合抗体开发后期应用。
Carterra LSA表位归类实验设计
一、实验目标
该实验利用Carterra LSA系统,通过氨基偶联法固定抗体到传感芯片表面,进行高通量的表位归类实验,从而分析抗体之间的表位竞争关系。
二、实验步骤
- 传感芯片准备
- 芯片清洗:使用超声波清洗器清洁传感芯片表面,确保去除所有潜在污染物。推荐使用丙酮和乙醇,然后用去离子水冲洗。如果需要,可用氨水(1%)处理芯片表面,以去除可能的有机物和脂类物质。
- 表面预处理:处理芯片表面时,使用HBS-EP缓冲液,去离子水冲洗干净,并避免出现气泡。确保芯片表面干净无污染。
- 氨基偶联固定
- 表面活化:
i. 将EDC和NHS按照1:1的比例分别溶解在HBS-EP缓冲液中,活化芯片表面。
ii. 反应时间:15分钟,活化完成后立即进行样品注入。
ii. 优化建议:为了提高偶联效率,活化步骤要严格控制反应时间,避免过度反应。 - 目标分子注入:
i. 目标抗体或抗原的浓度通常为1~10 µg/mL,溶解在HBS-EP缓冲液中。
ii. 注入时间:10~15分钟,根据反应的表面结合量来调整注入时间。
iii. 优化建议:监控注入曲线,确保目标分子能够充分结合且无过饱和。 - 表面封闭:
使用乙醇胺(1 M,pH 8.5)注入表面,封闭所有未反应的活性基团。注入时间为10分钟(根据实际效果可进行调整),确保完全封闭。这一过程可以有效防止非特异性结合。
- 表位归类实验
- 经典模式与预混模式选择:
i. 经典模式:逐个注射目标抗体和竞争抗体,通过竞争反应分析表位关系。
ii. 预混模式:目标抗体和竞争抗体预先混合,然后同时注入,快速筛选竞争关系。
iii. 优化建议:根据抗体的特性选择合适的实验模式。例如,对于高亲和力的抗体,建议采用经典模式,确保信号的分辨率。 - 样品注射与监测:
i. 确保抗体或抗原的精确注入。注入时间根据目标分子浓度和结合动力学调整。
ii. 使用 Carterra Navigator 软件 监测信号变化并捕捉数据,确保没有信号漂移。
- 再生和清洗
- 芯片再生:
i. 使用甘氨酸-HCl(pH 2.0~2.5)清洗芯片,去除所有非特异性结合物。每次再生后,确保系统能够恢复到基线水平。
ii. 优化建议:对于某些易失活的抗体,可以尝试使用温和的再生液,如醋酸钠缓冲液(pH 4.5),避免抗体变性。 - 系统检查:
在每次实验后检查芯片和流动系统的状态,确保没有气泡,流速稳定,且缓冲液没有受到污染。
- 数据采集与分析
- 数据采集:
使用Carterra LSA系统进行实时监控,记录信号曲线和变化。通过Carterra Navigator软件实时分析数据,确保每个数据点都能精确捕获。 - 数据处理与表位归类:
i. 通过 Carterra Navigator 软件 对抗体的结合和竞争情况进行定量分析,生成信号变化图和热图。将抗体根据表位竞争关系分为不同的表位组。
ii. 优化建议:对于不同抗体对的信号进行峰值和积分分析,确保数据的可靠性和精确度。
结果与数据分析
一、实验结果
抗体表位相关性树状图如图1所示,根据分析软件或已知表位相关性判断归类阈值。抗体表位相关性矩阵如图2所示,由对称性以及自阻断判断结果可信程度,本实验中矩阵显示相同抗体自阻断正常。抗体表位归类网络如图3所示,对数据进行汇总,结果如图4所示,可归为9组表位。
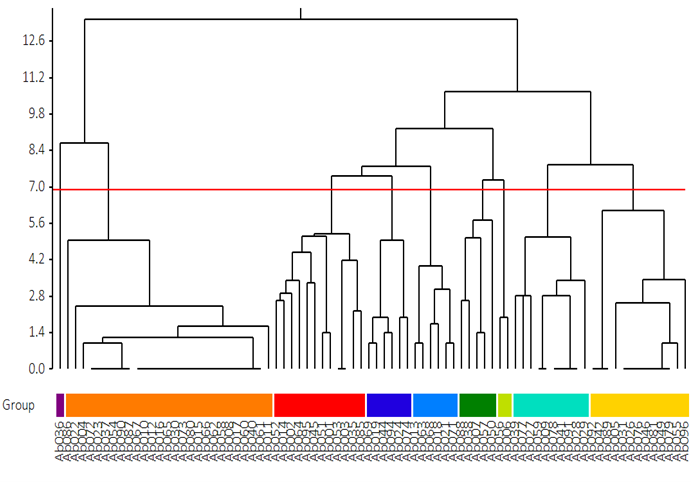
图1 抗体表位相关性树状图。 1. 关键分支注释:- 橙色框(Bin2):显著聚集分支(p<0.01),对应Bin2抗体群(占比>30%)。- 蓝色及红色框:高相关性抗体组(Bin1与Bin8),竞争抑制率>80%。2. 统计学方法:聚类算法:平均连锁法(Average Linkage)。
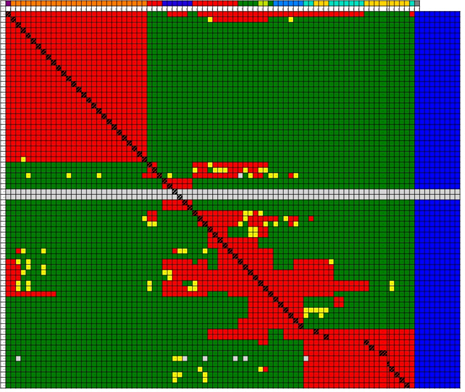
图2 表位相关性矩阵。 实验结果注释:竞争抑制热图显示自阻断,部分样本存在结合顺序差异。1. 自阻断验证:- 对角线区域为自阻断抗体对:所有自阻断实验信号降低>90%,验证系统可靠性。
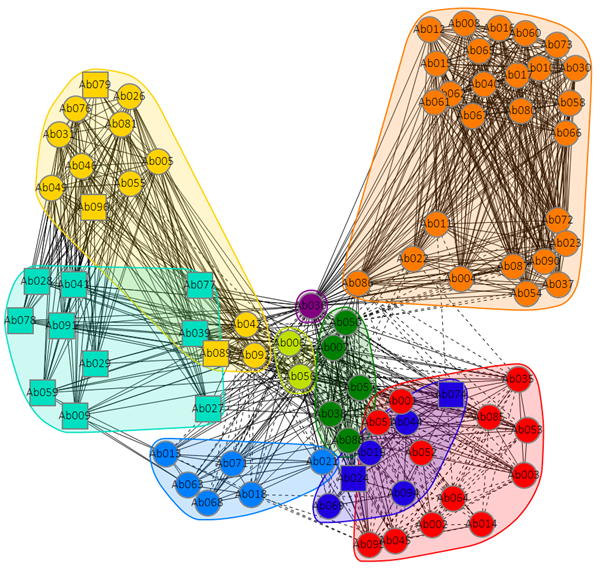
图3 抗体表位归类网络。 实验结果注释:节点大小=该Bin抗体数量。表位竞争网络揭示Bin1与Bin8存在交叉竞争,其他Bins相对独立。
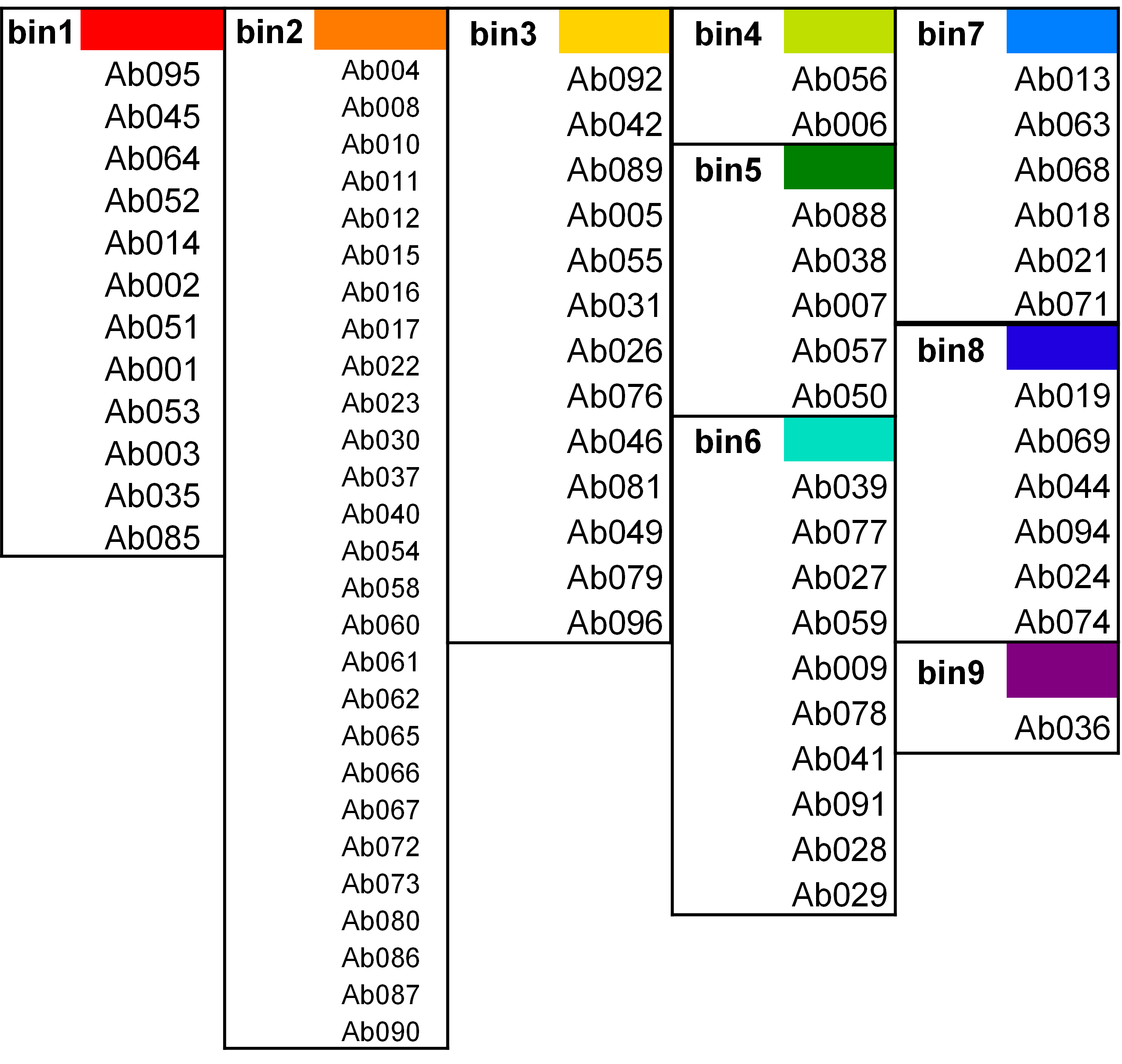
图4 抗体表位归类数据汇总
二、实验结论
本次共检测样品96个抗体对,抗体表位矩阵图(图2)显示抗体自阻断正常,抗体对反向阻断对应性良好,部分反向阻断体现出不同结果,可判断为空间表位影响。抗体表位归类网络图(图3)显示不同表位间存在相关性,显示此抗体库中的96个抗体对表位多样性性强。根据最终的归类结果汇总(图4)可以分为9个bin,其中bin2的抗体最多,且该bin的独立性较强。bin1和bin8的相关性较强。经核对其中5对样品与Biacore 8K验证的结论不符。可能涉及多种技术或实验设计因素。以下是关键原因分析及排查方向:
检测原理差异:
| 参数 | SPRi | Biacore 8K |
| 检测技术 | 全阵列成像(固定角度) | 多通道微流控(动态角度) |
| 流体控制 | 静态/微流(易有边缘效应) | 精准微流控(均一性高) |
| 表面均一性 | 芯片涂层批次差异风险高 | 流道标准化程度高 |
影响:SPRi对分子聚集或表面不均匀更敏感,可能导致弱结合信号偏差。
实验条件差异:
结合时间:SPRi的静态孵育 vs Biacore的动态流动,影响竞争平衡(尤其对快解离抗体)。
缓冲液组分:添加剂(如吐温20浓度)微小差异可能改变表位构象。
表位构象敏感性差异:
若目标表位为空间构象表位,SPRi的固定化方式(如氨基偶联)可能使抗体或抗原固化后的空间方向不一致,而Biacore的捕获法(如His-tag捕获)保留天然构象并且空间方向一致。
该实验耗费时间:样品准备及芯片制作约8小时,仪器运行50小时,总时间约为60小时。通过调整上样浓度以及反应时间,可以缩短整体实验时间,存在很大的效率的提升空间。Carterra LSA平台可以通过直接偶联法,在短时间内高通量进行表位归类验证。
三、实验要点与优化
- 样品准备
- 抗体偶联或抗原捕获:
i. Carterra LSA和Biacore 8K:建议优化EDC/NHS 偶联条件,包括pH和偶联剂浓度,以确保靶分子的稳定结合并避免表位遮挡。对于不稳定或表位敏感的抗原,可尝试使用疏水吸附方式固定。
ii. Octet RED384:推荐His标签捕获方式,并测试不同His标签长度(如6× His与8× His)和缓冲液条件(PBS vs. HBS-TE)以提高捕获效率,同时控制抗原密度以避免信号不均匀。 - 抗体稀释:
i. Carterra LSA和Biacore 8K:Analyte和Competitor抗体稀释至100–500 nM,以适应 SPR系统的灵敏度范围。
ii. Octet RED384:推荐稀释范围为50–500 nM,确保光程偏移信号在有效范围内。
- 数据采集与分析
- 竞争矩阵生成:
i. Carterra LSA的热图功能便于快速分类抗体,建议对边缘信号强度较低的样本进行额外验证,避免误分类。
ii. Biacore Insight软件可通过交叉验证完全竞争抗体组的亲和力数据,进一步验证表位分组结果。 - 干扰信号控制:
在所有平台上,建议在缓冲液中添加适量BSA或去污剂(如0.05% Tween-20),以减少非特异性结合并降低背景噪音。
- 硬件维护与再生条件
- Carterra LSA和Biacore 8K:建议使用10 mM Glycine-HCl(pH 1.7)清洗芯片,严格遵循再生程序以延长芯片使用寿命并保持数据一致性。
- Octet RED384:定期清洁传感器,并避免长期暴露于干燥环境中,以确保信号稳定性。
- 实验结果验证
- 多平台交叉验证:对于关键抗体组,推荐结合Carterra LSA和Biacore 8K的动力学分析结果,确保表位分组和亲和力数据一致。
- 重复实验:针对Biacore 8K和Octet RED384,建议在每组实验中进行重复测试,以提高结果的统计置信度。
- 固定策略对比:在Carterra LSA上并行测试 氨基偶联 vs His-tag捕获 对异常样本的影响。
- 竞争模式优化:对快解离抗体采用 预混合-延长孵育(10 min)提升检测灵敏度。
四、结论
- 技术平台对比
Carterra LSA、Sartorius Octet RED384和Biacore 8K各有其技术特点和适用场景:- Carterra LSA:结合高通量筛选和动力学分析的能力,适合各阶段的大规模抗体开发任务。
- Octet RED384:操作便捷,适合抗体开发早期的大规模筛选。
- Biacore 8K:以高灵敏度和精确动力学测定见长,适用于抗体开发后期的验证阶段。
- 表位归类实验的未来趋势
- 平台整合:根据不同实验需求,可基于SPR的高精度/SPRi(Carterra LSA)高通量和BLI高灵活性,满足高通量筛选和精确动力学分析的需求。
- 人工智能辅助分析:机器学习模型正在逐步应用于表位竞争数据的分析,进一步提升数据处理效率和准确性。
- 高通量与自动化发展:针对大规模抗体库的筛选需求,未来平台可能进一步提升样品处理能力,并实现更高水平的实验自动化[6–9]。
- 应用展望
- 精准医疗:表位归类数据可优化治疗性抗体的联合用药策略,支持精准医疗实施。
- 疫苗研发:在针对病毒病原体的抗体开发中,表位归类实验能够快速筛选出高效中和抗体,为疫苗设计提供数据支持。
- 专利保护:表位数据能够支持知识产权布局,通过识别关键结合区域保障抗体药物的市场竞争力。
溶液配方
- 10× HBS-EP+
分别称取23.83 g HEPES,8.77g EDTA,87.66 g NaCl,量取5 mL Surfactant P20于烧杯中,去离子水定容至1L,调pH值至7.4±0.1,室温保存。 - 1× HBS-EP+
量取100 mL 10× HBS-EP+,去离子水定容至1 L,调pH值7.4 ± 0.1,现配现用。量取100 mL 10× HBS-EP+,去离子水定容至1 L,调pH值6.0 ± 0.1,现配现用。 - 再生液配制
量取Glycine 0.75 g,去离子水定容至1L,调pH值1.5~2.0,4 ℃保存,有效期1个月。
参考文献
- Alt, N., Zhang, T. Y., Motchnik, P., Taticek, R., Quarmby, V., Schlothauer, T., Beck, H., Emrich, T. and Harris, R. J. (2016). Determination of critical quality attributes for monoclonal antibodies using quality by design principles. Biologicals 44(5): 291–305. https://doi.org/10.1016/j.biologicals.2016.06.005
- Aboul-Ella, H., Gohar, A., Ali, A. A., Ismail, L. M., Mahmoud, A. R., Elkhatib, W. F. and Aboul-Ella, H. (2024). Monoclonal antibodies: From magic bullet to precision weapon. Mol Biomed. 5(1): 1–4. https://doi.org/10.1186/s43556-024-00210-1
- Peng, P., Liu, C., Li, Z., Xue, Z., Mao, P., Hu, J., Xu, F., Yao, C. and You, M. (2022). Emerging ELISA derived technologies for in vitro diagnostics. TrAC, Trends Anal Chem. 152: 116605. https://doi.org/10.1016/j.trac.2022.116605
- Schasfoort, R. B. M. (2017). Future Trends in SPR Technology. Handbook of Surface Plasmon Resonance : 415–478. https://doi.org/10.1039/9781788010283-00415
- Blay, V., Tolani, B., Ho, S. P. and Arkin, M. R. (2020). High-Throughput Screening: today’s biochemical and cell-based approaches. Drug Discov. 25(10): 1807–1821. https://doi.org/10.1016/j.drudis.2020.07.024
- Matharu, Z., Bee, C., Schwarz, F., Chen, H., Tomlinson, M., Wu, G., Rakestraw, G., Hornsby, M., Drake, A., Strop, P., et al. (2021). High-Throughput Surface Plasmon Resonance Biosensors for Identifying Diverse Therapeutic Monoclonal Antibodies. Anal Chem. 93(49): 16474–16480. https://doi.org/10.1021/acs.analchem.1c03548
- Carterra, Inc. (2020). Addressing viral pandemics such as COVID-19 using the Carterra® LSATM [White paper]. https://www.carterra-bio.com/resources/white-papers
- Jug, A., Bratkovič, T. and Ilaš, J. (2024). Biolayer interferometry and its applications in drug discovery and development. TrAC, Trends Anal Chem. 176: 117741. https://doi.org/10.1016/j.trac.2024.117741
- Schasfoort, R. B.(Ed.). (2017). Handbook of surface plasmon resonance. Royal Society of Chemistry.
引用格式:李健晖. (2025). 基于分子互作技术的表位归类实验平台比较及优化策略:Carterra LSA应用分析. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011031. DOI:
10.21769/BioProtoc.1011031.
 How to cite:
How to cite: Li, J. H. (2025). Comparison and Optimization of Epitope Binning Platforms Based on Molecular Interaction Technologies: Application Analysis of Carterra LSA. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011031. DOI:
10.21769/BioProtoc.1011031.
