材料与试剂
材料:
- 15 ml离心管 (Corning, catalog number: 430791)
- 10 ml移液管 (Corning, catalog number: 4488)
- 1.5 ml离心管 (Axygen, catalog number: MCT-150-C)
- 96孔圆底板 (Corning, catalog number: 351177)
- BD Falcon流式管 (Corning, catalog number: 352052)
- 70 μm滤膜 (Corning, catalog number: 352350)
- 肝素抗凝管
试剂:
- Anti-Mouse Ig, κ/Negative Control Compensation Particles Set (Ms Ig Kpa Comp Bead Set 6Ml, BD Biosciences, catalog number: 552843)
- Lonsera乌拉圭 (南美) 特级胎牛血清 (Lonsera, catalog number: S711-001S)
- Lymphoprep (Stemcell, catalog number: 07851)
- 20x PBS缓冲液 (生工,catalog number: B548117)
- 0.5 mol/L EDTA (生工,catalog number: B300599)
- Trypan Blue 0.4% solution in 0.85% NaCl (Lonza, catalog number: 17-942E)
- 1x PBS (见溶液配方)
- FACS buffer (见溶液配方)
- 抗体混合物 (见溶液配方)
抗体:
- Mouse antihuman CD32-BUV395 (BD Biosciences, custom)
- Mouse antihuman CD16-BUV496 (BD Biosciences, custom)
- Mouse antihuman CD19-BUV563 (BD Biosciences, custom)
- Mouse antihuman IgD-BUV615 (BD Biosciences, custom)
- Mouse antihuman CD4-BUV661 (BD Biosciences, custom)
- Mouse antihuman CD64-BUV737 (BD Biosciences, custom)
- Mouse antihuman CD14-BUV805 (BD Biosciences, custom)
- Mouse antihuman CD57-BV421 (BD Biosciences, custom)
- Mouse antihuman CD3-BV480 (BD Biosciences, custom)
- Mouse antihuman CD15-BV650 (BD Biosciences, custom)
- Mouse antihuman CD27-BV711 (BD Biosciences, custom)
- Mouse antihuman CD20-BV750 (BD Biosciences, custom)
- Mouse antihuman CD197-BV786 (BD Biosciences, custom)
- Mouse antihuman CD45RA-BB515 (BD Biosciences, custom)
- Mouse antihuman TCRgd-BB630 (BD Biosciences, custom)
- Mouse antihuman CD195-BB660 (BD Biosciences, custom)
- Mouse antihuman CD8-Percp-cy5.5 (BD Biosciences, custom)
- Mouse antihuman CD38-BB790 (BD Biosciences, custom)
- Mouse antihuman CD11c-PE (BD Biosciences, custom)
- Mouse antihuman CD13-PE-CF594 (BD Biosciences, custom)
- Mouse antihuman CD123-PE-Cy5 (BD Biosciences, custom)
- Mouse antihuman CD25-PE-Cy7 (BD Biosciences, custom)
- Mouse antihuman CD127-AF647 (BD Biosciences, custom)
- Mouse antihuman CD56-APC-R700 (BD Biosciences, custom)
- Mouse antihuman HLA-DR-APC-H7 (BD Biosciences, custom)
仪器设备
- 实验室2级生物安全柜 (Thermo Scientific™ 1300 Series A2 Biological Safety Cabinet Packages)
- 高速离心机 (Thermo Scientific™ Sorvall™ ST 40离心机)
- 倒置相差显微镜 (Olympus, model: CKX41)
- 血细胞计数板 (Sigma-Ardrich, model: BR717805-1EA)
- X30流式细胞分析仪 (BD FACSymphony™系统)
- 电动移液器 (Eppendorf, model: 4430000018)
实验步骤
一.人外周血免疫细胞的制备 (Gupta等,2013)
- 准备洁净的15 ml离心管,倒入3 ml lymphoprep。抽取健康人外周血置于肝素抗凝管中备用,在无菌的15 ml离心管中加入3 ml人外周血, 再加入3 ml 1x PBS后 (文中未特殊说明均为1x PBS) 进行混匀稀释。左手倾斜离心管,右手用移液器吸取稀释后的外周血缓慢加到lymphoprep表面,形成密度梯度。在加入外周血的过程中,可适当缓慢摆正离心管,注意加液体时要轻柔,移液器的速度调整到最低,以免将lymphoprep和外周血混匀 (图1)。

图1. 密度梯度离心上样结果示意图
- 400 x g,20 min,升速 (ACC) 1,降速 (DEC) 0,室温进行密度梯度离心。
- 离心结束后离心管内液体分为5层,从上到下分别为:血浆,外周血单个核免疫细胞 (包括外周血单核细胞和淋巴细胞等),lymphoprep,粒细胞,红细胞 (图2)。准备干净的15 ml离心管,加入10 ml PBS,用吸管吸取第二层的外周血免疫细胞并转入含有PBS的离心管中,上下颠倒后放入离心机800 x g,10 min室温离心 (视频1)。

图2. 密度梯度离心产物示意图
视频1. 吸取密度梯度离心后中间层淋巴细胞和单核细胞的过程
- 离心结束后去上清,轻弹管底,再加入10 ml PBS,上下颠倒后放入离心机400 x g,5 min室温离心。
- 重复步骤4清洗外周血免疫细胞以彻底去除残留的lymphoprep。
- 最后得到的细胞沉淀就是外周血免疫细胞,可用PBS重悬细胞后进行细胞计数。理论上,1 ml外周血可得到1 x 106左右外周血免疫细胞。
二.25色流式染色实验 (参考文献1)
25色流式染色和正常流式染色步骤一致,本实验研究的25色全景分析所用的抗体均为表面抗体,因此只需要进行常规流式表面染色。
- 配制抗体混合物。一个反应体系为100 μl,按照抗体说明书建议的最佳稀释比例 (2.5 μl/test) 用FACS buffer (见溶液配方) 对不同的抗体进行稀释。
注:由于最终体积为100 μl,且人相关抗体的使用量较多,所以溶剂FACS buffer的体积需要减去各个抗体的使用体积。且所有的抗体需要避光操作,避免荧光猝灭;抗体开盖之前需要先离心避免管壁上的抗体飞溅引起浪费;抗体不易长时间在室温放置,建议置于冰上使用。 - 取1 x 106个外周血免疫细胞,用抗体混合物重悬细胞,置于96孔板中,充分混匀后4 °C避光孵育30 min。
- 染色结束后,直接加入150 μl FACS buffer清洗细胞,400 x g,5 min室温离心。
- 离心结束后去上清,用300 μl FACS buffer分两次重悬细胞沉淀,再将细胞通过70 μm滤膜过滤到流式管中,即可上机观察。
- 在表面染色的过程中,我们需要制作25色染色方案的单染管用于流式自动调节补偿。取26个流式管,分别标上各个通道的荧光名称,第26个为空白管,每个流式管中加入两滴Ms Ig Kpa Comp Bead (约有50 μl的体积),混匀后,对应管壁上标注的荧光通道加入之前染色使用的表面抗体各0.25 μl,1:200稀释。充分振荡混匀后4 °C避光孵育15 min,各加入400 μl FACS buffer,混匀后即可用于流式分析。
注:Ms Ig Kpa Comp Bead使用前需要充分摇匀。
三.25色全景分析 (van der Maaten和Hinton,2008;Wallach和Liliean,2009;Monaco等,2016)
得到流式结果后,需要使用正版flowjo V10软件对结果进行全面分析 (视频2)。
- 在flowjo V10中导入数据后,我们需要对25色补偿进行手动调整。主要是因为小球调整的补偿和细胞真实的补偿存在一定的差异,所以还需要手动确认 (图3)。
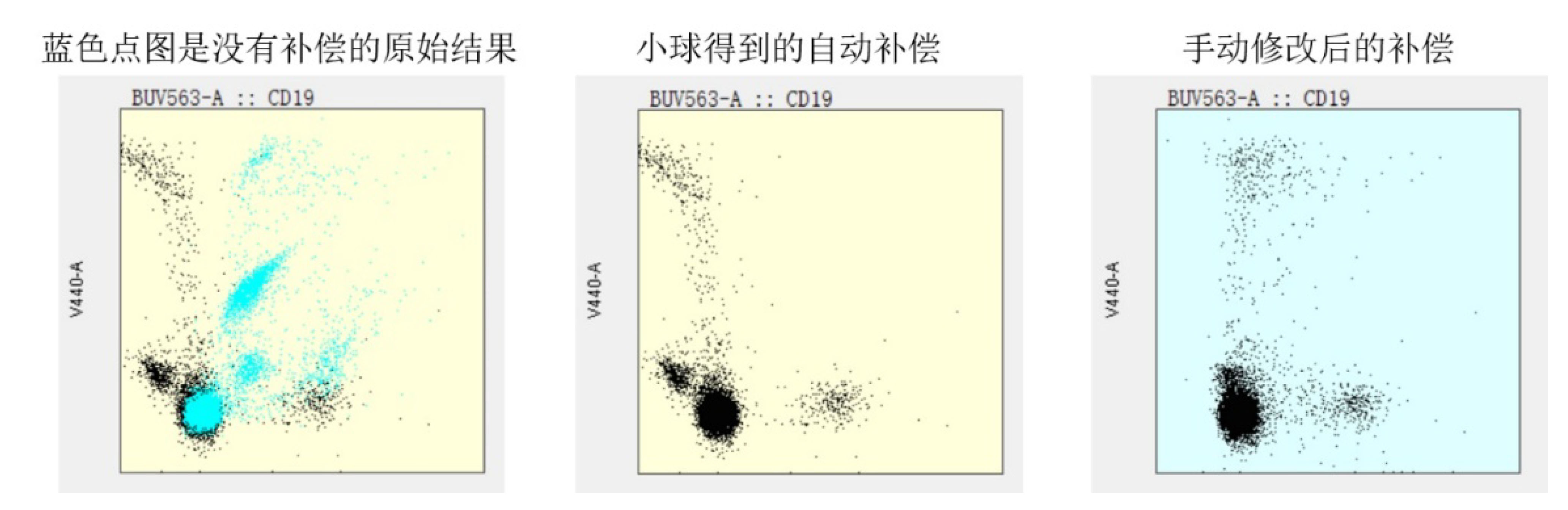
图3. 手动确认补偿的结果对比图
- 去除原始数据中由于液流不稳定等机器原因导致的噪音信号。主要使用plugin插件中的flow AI得以实现 (图4)。
注:使用flow AI选择参数时,必须选中time参数,不然将无法计算相关参数。
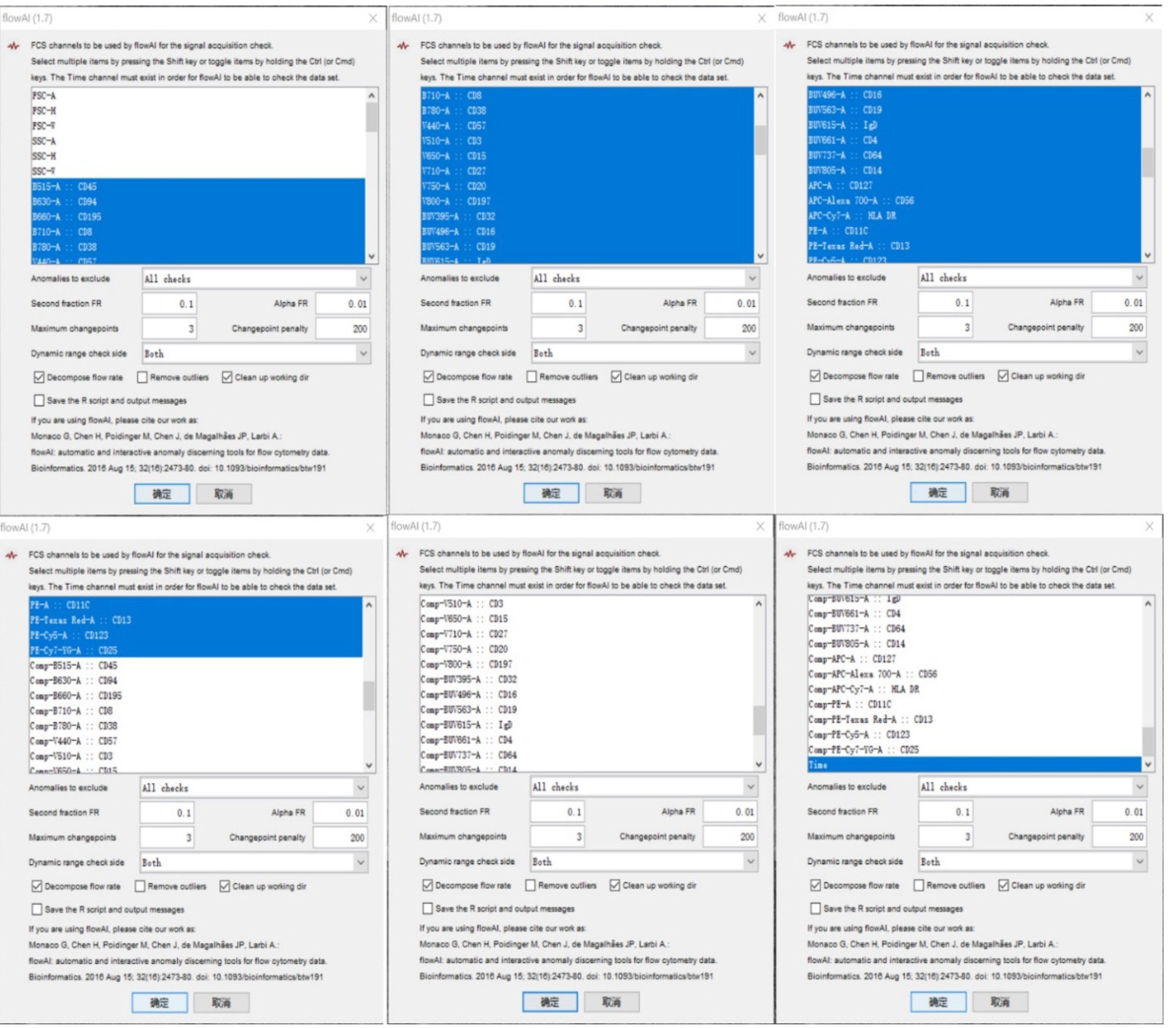
图4. 运行flow AI的参数选择
- 运行结束后,我们将看到原始数据拆分成了bad events和good events两项。之后我们可以对good events进行常规的圈门统计分析 (图5)。
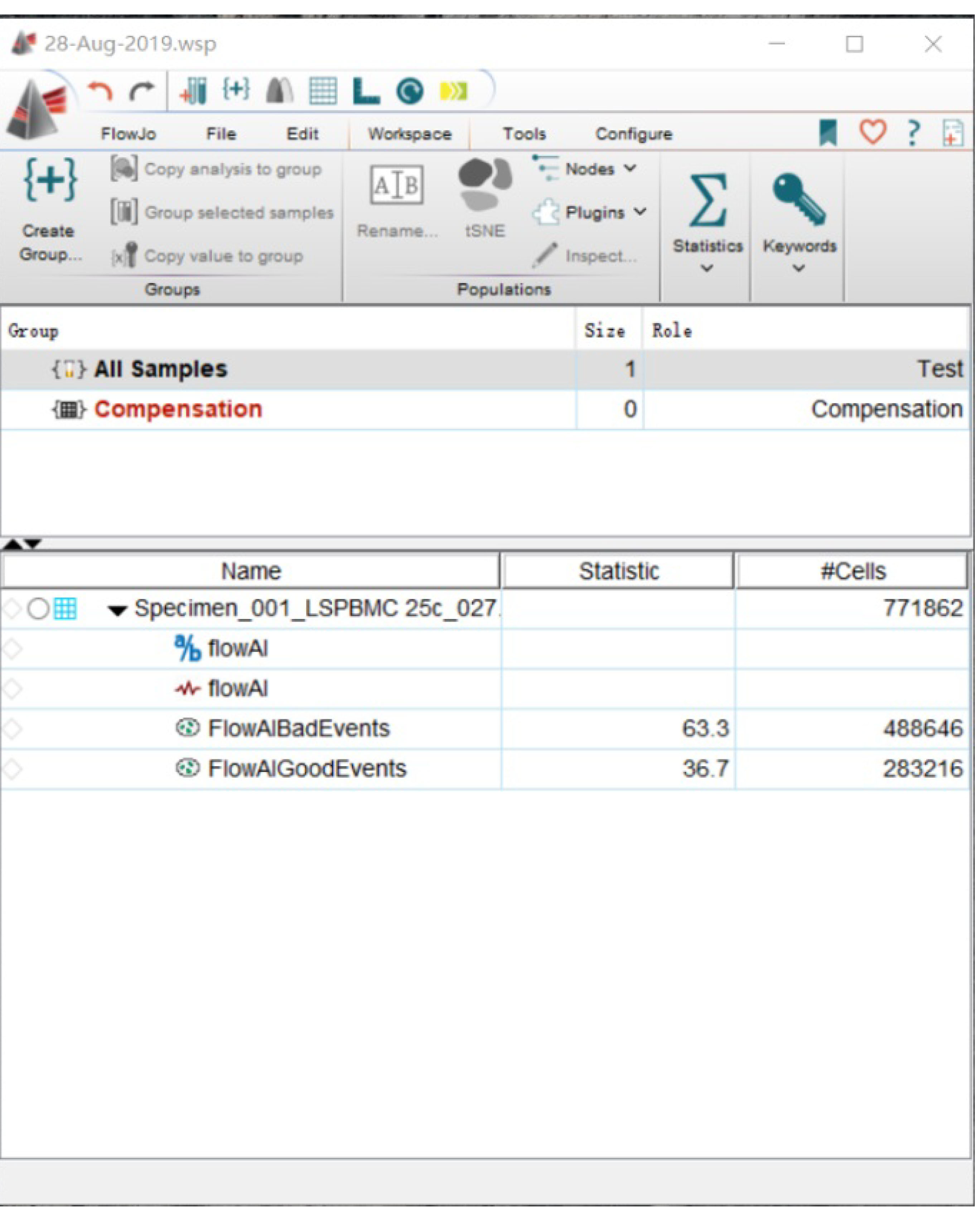
图5. Flow AI运行后的结果界面
- 正版flowjo包含了很多实用性的插件:t-SNE,SPADE,FlowSOM,Phenograph,UMAP等等。其中本实验主要运用了t-SNE这个算法对25色结果进行全景分析。t-SNE主要对多参数的数据进行降维分析,通过定义纳入分析的参数通道,算法可将细胞分成不同距离远近的点,距离越远代表细胞相似度越低。我们在圈出的淋巴细胞的基础上,先downsample出7万个淋巴细胞,针对这7万个细胞,我们选中除FSC、SSC相关参数以外的所有补偿后的荧光参数 (一共25个通道参数),进行t-SNE分析 (图6,视频3)。
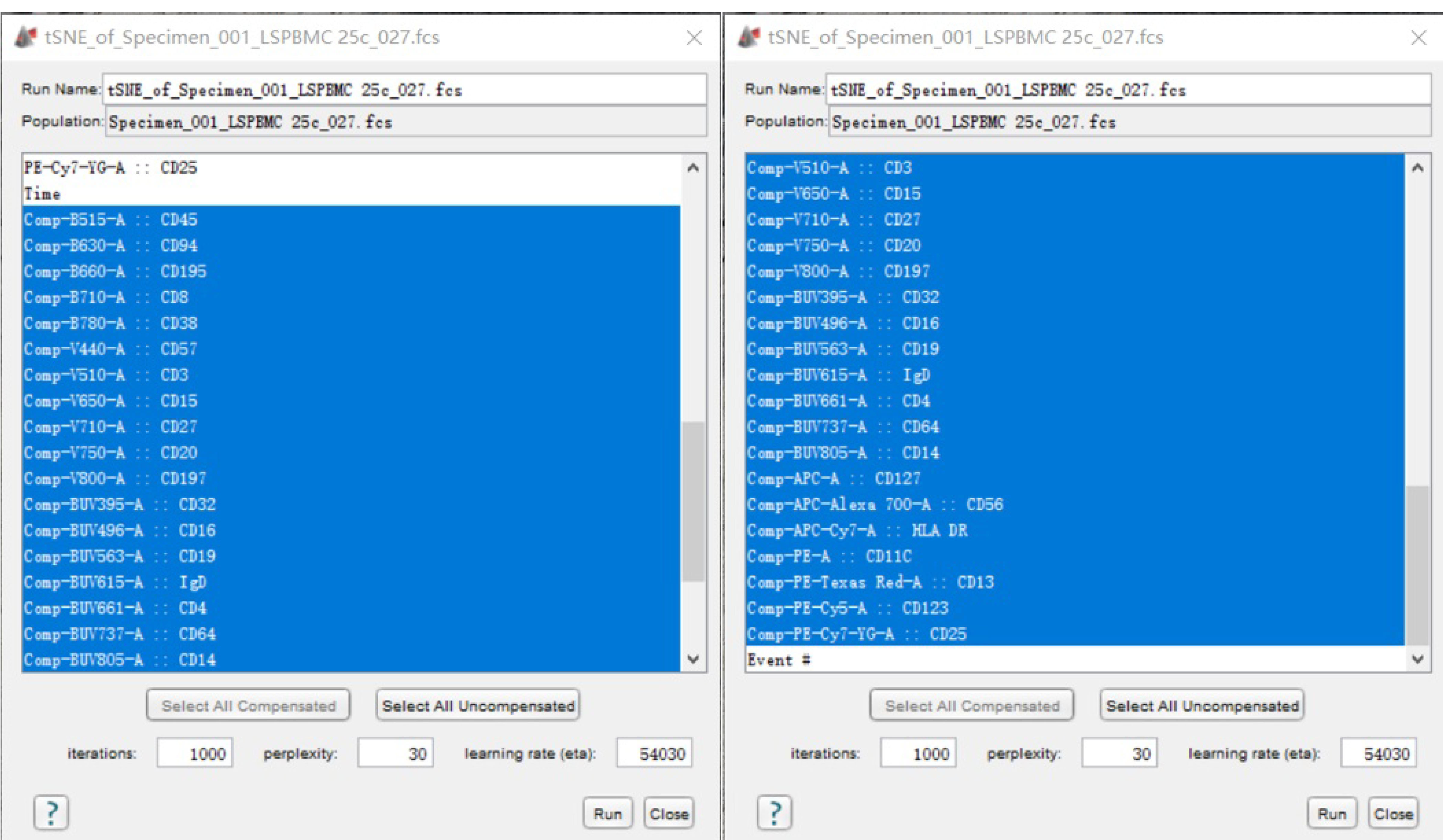
图6. t-SNE分析的参数选择
视频3. t-SNE分析教程
- 分析结束后,结合传统的淋巴细胞亚群定义 (即结果图7中的圈门方法),我们在layout界面将这几群细胞以t-SNE1和t-SNE2为横纵坐标的点图merge在一起并导出,结束分析。
结果与分析
本实验先根据细胞大小和包含的颗粒度,即FSC和SSC,将人外周血免疫细胞主要分成淋巴细胞群和单核细胞群等。然后,我们观察了CD3、CD19的表达情况,其中CD3+为T细胞群,占白细胞64.6%,CD19+为B细胞群,占白细胞8.45%。细分T细胞,通过CD4和CD8,可以将T细胞分为辅助T细胞和杀伤性T细胞,两者分别占T细胞的64%和30%。对于辅助T细胞,我们还检测了其中一个亚群Treg的比例,其约占辅助T细胞的7.85%。CD3+CD56+的细胞群为NKT细胞,大约占T细胞的5.72%。细分B细胞,IgD+的naïve B细胞约占总B细胞的52.1%,CD27+的记忆B细胞约占总B细胞的27%。
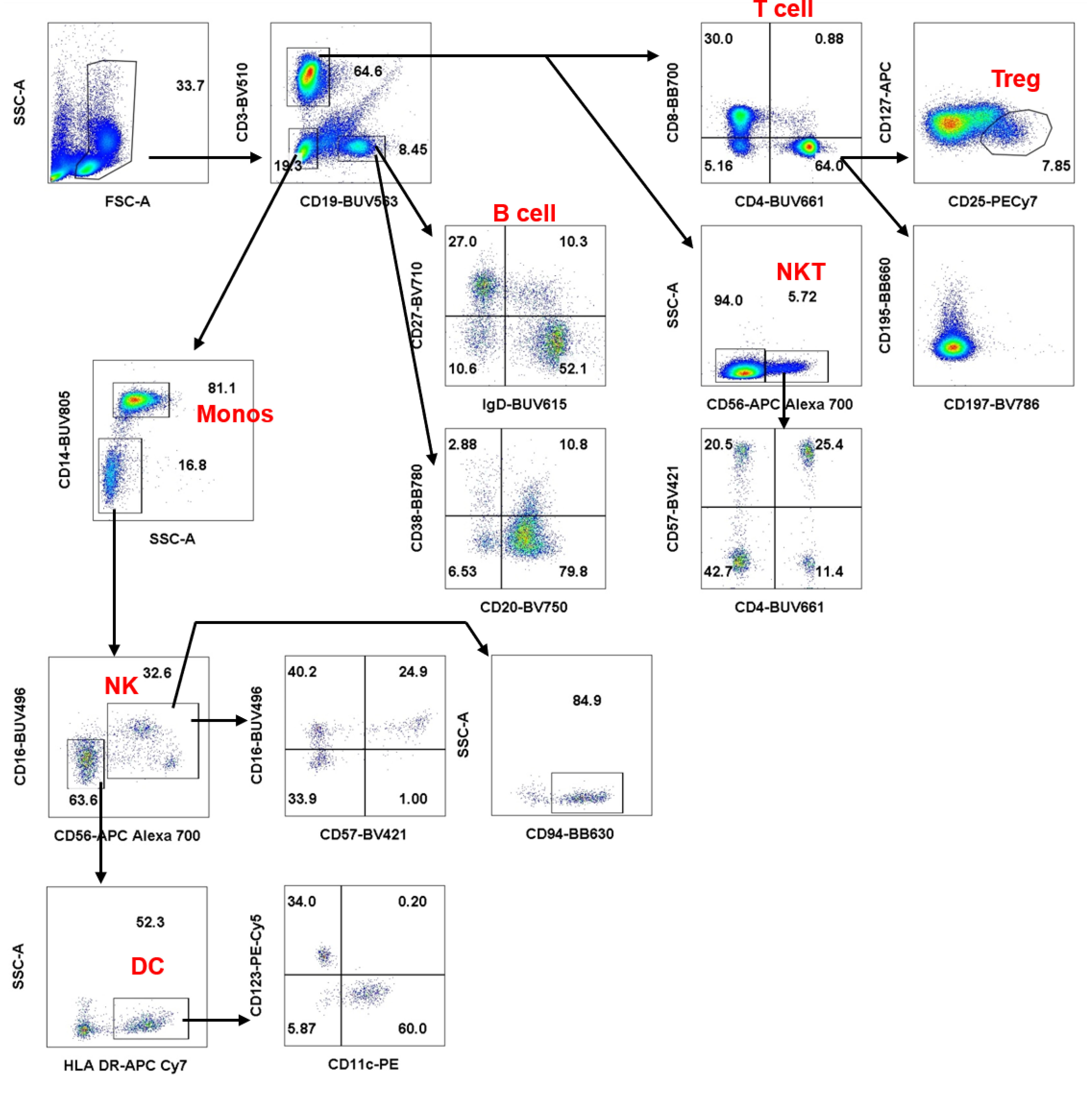
图7. 人外周血免疫细胞亚群分类. 根据文献报道的不同免疫细胞亚群的定义,在本次实验中主要划分了T细胞 (CD3+)、B细胞 (CD19+)、NKT细胞 (CD3+CD56+)、NK细胞(CD3-CD19-CD16+CD56+)、DC(CD3-CD19-CD56-HLA DR+)、单核细胞(CD3-CD19-CD14+)等不同免疫细胞亚群。
CD3-CD19-的双阴性细胞群既包含淋巴细胞群又包含单核细胞群。因此根据CD14的表达情况和细胞内颗粒度 (SSC),可将细胞群划分为CD14+单核细胞群和CD14-淋巴细胞群。细分CD14-CD3-CD19-淋巴细胞群,其中CD56+为NK细胞,约有84.9%的细胞高表达CD94,用于识别MHC I。而CD56-为DC细胞群,其中约有52.3%表达HLA-DR。存在的问题是,本次实验关于单核细胞群的分类并不明显,猜测是本次样品粒细胞群不明显的问题。通过25色大panel,我们可以最大程度一次性观察所有人外周血免疫细胞亚群并得到相应的细胞比例。
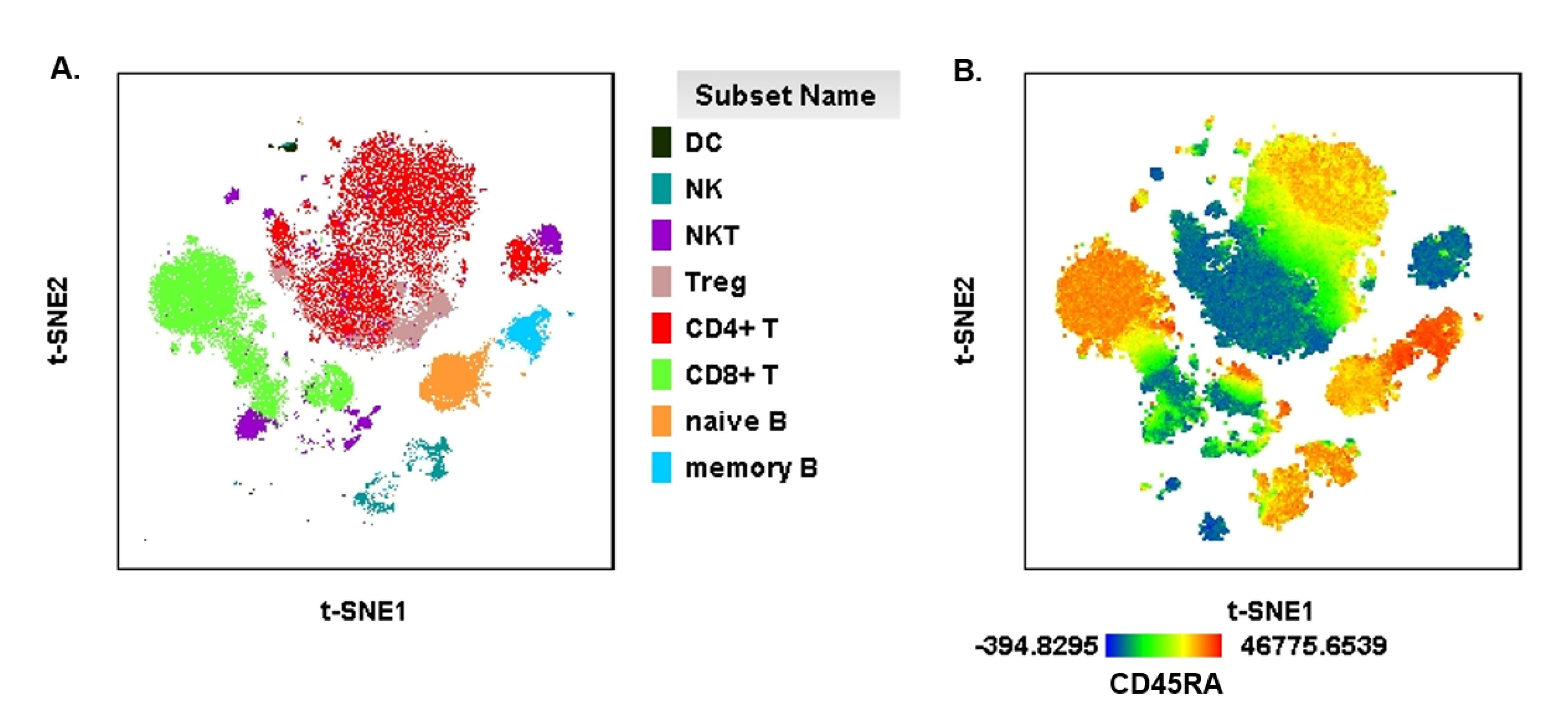
图8. 人外周血免疫细胞群的t-SNE分析. 取7万个免疫细胞进行t-SNE分析,分析参数为补偿后的25个maker。A. 流式圈门后的不同细胞群显示t-SNE界面并合并在一起得到细胞群降维后的分布形态。B. 在t-SNE分布图上根据每个细胞CD45RA的表达情况 (即平均荧光强度) 做的热图,红色代表CD45RA表达高,蓝色代表表达低。
t-SNE全称t-distributed stochastic neighbor embedding,可将多维参数经迭代计算后在二维坐标轴上进行展示。通过计算,t-SNE分布图由多个散点组成,每个散点代表一个细胞,两个散点之间的距离代表着两个细胞的相似程度。距离越近,则相似程度越高。另外,在正版flowjo V10版本中,还可以观察t-SNE heatmap,即在t-SNE坐标轴中展示某一个参数的表达水平。在图8A中,最明显的比例最高的红色细胞群为辅助T细胞,粉色的Treg细胞群位于其中,这与Treg属于辅助T细胞这一常识相一致,说明本次t-SNE分析可信。由于NKT细胞表达CD4或CD8,因此一部分NKT亚群靠近辅助T细胞,一部分NKT靠近杀伤性T细胞,因而紫色的NKT细胞表现出很高的异质性。因为t-SNE是综合25个参数进行的分析,所以我们可以发现不同淋巴细胞内部的异质性。图8B中T细胞的异质性主要体现在CD45RA的表达上,由于不同的T细胞关于CD45RA的表达不一致,从而出现明显的亚群分类。另外,加入其它有意义的maker,有助于发现新的细胞亚群。
失败经验
- 人外周血免疫细胞制备的失败
制备失败的主要原因通常是密度梯度离心出现问题。一方面,可能是加入的lymphoprep和血液混匀了,那样将无法形成密度梯度,也就无法得到人外周血免疫细胞。另一方面,可能是离心出现问题。为了保证密度梯度稳定存在,离心机降速必须调至最小,否则高降速会导致lymphoprep和血液混匀,无法形成密度梯度。一般注意以上两点就可成功得到外周血免疫细胞。 - 流式结果无法得到正常细胞分群
有很多因素会导致这个问题:1)抗体有问题。由于25色大panel中的抗体存在很多非常见荧光和克隆号,以及一些定制抗体的存在,我们拿到新抗体必须先检测抗体是否可用,才能用于后续的正式实验。2)补偿有问题。25色大panel中用到了25种荧光通道,很多通道的接收波段非常接近,且荧光存在溢漏,会导致补偿问题很严重。所以除了最初花费大量精力在上机时调整最佳电压,我们还需要在分析数据时手动二次确认补偿,以减小最后的误差。3)样本的问题,对此需要重新挑选病人血样、优化样品制备流程。
溶液配方
- 1x PBS
用双蒸水稀释20x PBS得到
121 °C、20 min高压灭菌后室温保存 - FACS buffer
在PBS中加入1% FBS和2 mM EDTA
4 °C保存 - 抗体混合物
在37.5 μl FACS buffer中各加入2.5 μl表面抗体,共25种抗体合计62.5 μl,最终一个样本的反应体积为100 μl
致谢
感谢沈蕾实验室各位研究生同学对本实验方法的帮助和改进。本实验得到国家自然科学基金项目 (81571533) 的资助。
参考文献
- Affymetrix. (2008). Staining Cell Surface Targets for Flow Cytometry. Flow Cytometry-BestProtocols® 1-5.
- Gupta, R., Puleo, A. and Maecker, H. (2013). Isolation of PBMCs-Direct Overlay on Ficoll (Heparin). Standard Operating Protocol-HIMC 1.4.
- Monaco, G., Chen, H., Poidinger, M., Chen, J., de Magalhaes, J. P. and Larbi, A. (2016). flowAI: automatic and interactive anomaly discerning tools for flow cytometry data. Bioinformatics 32(16): 2473-2480.
- van der Maaten, L. and Hinton, G. (2008). Visualizing data using t-SNE. J Mach Learn Res 9: 2579-2605.
- Wallach, I. and Liliean, R. (2009). The Protein-Small-Molecule Database, A Non-Redundant Structural Resource for the Analysis of Protein-Ligand Binding. Bioinformatics 25 (5): 615-620.
引用格式:章晶晶, 沈蕾. (2019). 人外周血免疫细胞亚群25色流式全景分析.
Bio-101: e1010325. DOI:
10.21769/BioProtoc.1010325.
 How to cite:
How to cite: Zhang, J. J. and Shen, L. (2019). Immune Cell Landscape of Human Peripheral Blood by 25 Colors Flow Cytometry .
Bio-101: e1010325. DOI:
10.21769/BioProtoc.1010325.
